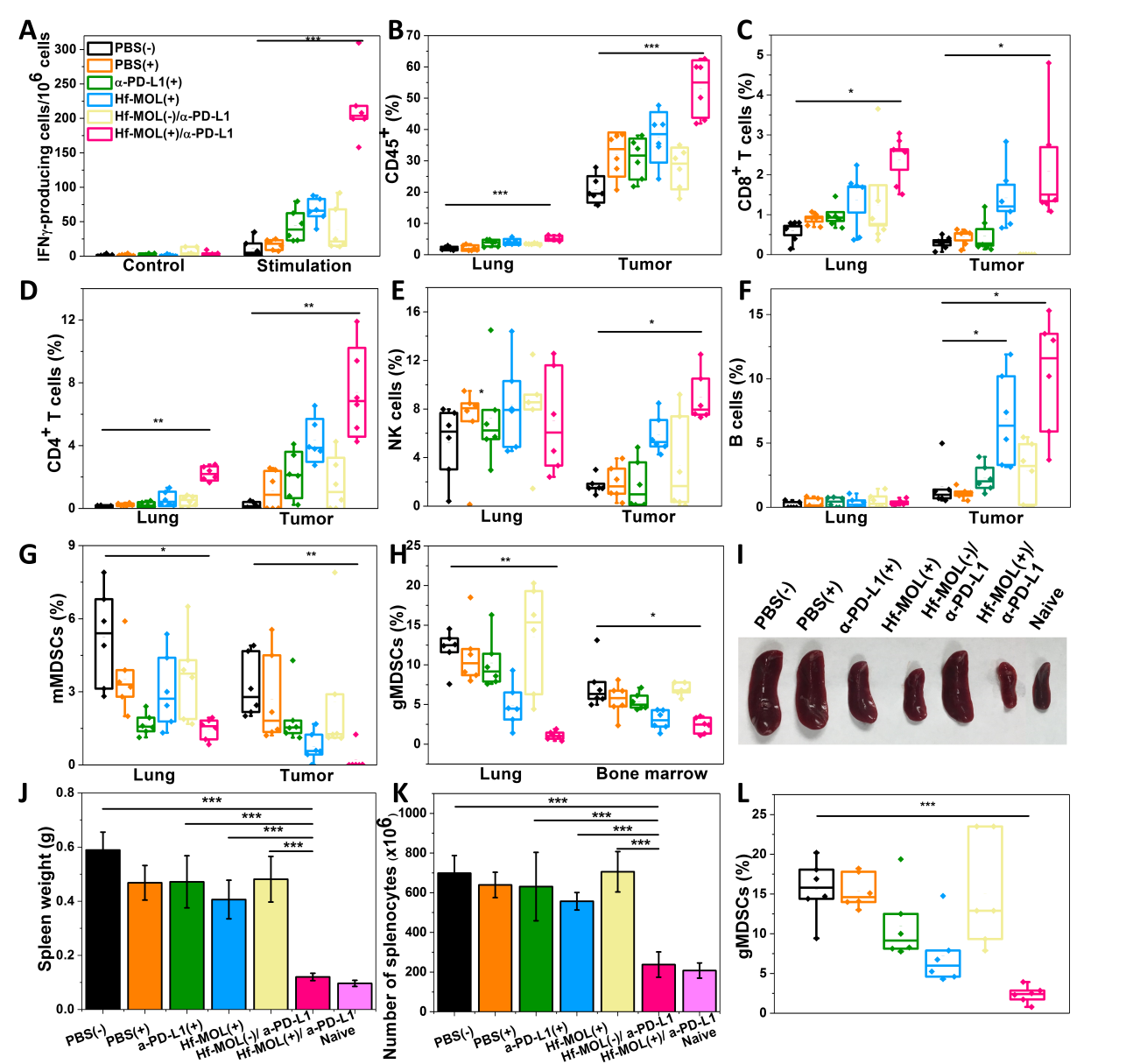1. 首次报道了单层结构的Hf-MOL用于增强放射-放射动力治疗。2. nMOL介导的放射-放射动力治疗与免疫检测点阻断疗法有效结合协同消除原位肿瘤,更能抑制远端转移。3. 报道的联合治疗有效降低gMDSCs,具有抑制远端转移灶的形成作用。免疫疗法是目前癌症治疗的研究热点。肿瘤可以逃避免疫监视,通过调节信号通路紊乱、劫持免疫抑制细胞和细胞因子、耗竭效应细胞和分子,从而避免被免疫系统消除。免疫检测点阻断疗法(checkpoint blockade immunotherapy,CBI)能够通过抗体阻断程序性细胞死亡蛋白-1(PD-1)及其与配体(PD-L1)等负向免疫调控通路以重新激活肿瘤免疫。近年来,被批准的几种抗PD-1和抗PD-L1抗体在一些癌症上表现出良好的治疗效果,已在美国、欧洲和中国获批用于临床。然而,T细胞浸润低、肿瘤抗原提呈效率不够、以及缺少对宿主免疫系统的激活等诸多因素使得疫检测点阻断疗法在针对实体瘤时表现不佳。因此,寻找有效的致免疫原性的辅助疗法用于与免疫检测点阻断疗法结合成为进一步提升癌症治疗的新方向。目前,常用的光动力疗法、光热疗法已被证明具有很强的致免疫原性,能有效与CBI结合。然而,由于光存在组织穿透性差的缺点,使得这些疗法难以实现临床应用。而广谱的放射疗法使用组织穿透性好的高能射线作为外界能量源杀伤肿瘤细胞产生局部炎性可有效解决这一问题。目前,临床上已有超过150项在研实验正在论证放疗与CBI联用的疗效与愈后。然而,低肿瘤灶能量截留与低癌细胞毒性限制了放疗用于肿瘤特异性杀伤结合CBI的潜力。基于这些问题,林文斌团队报道了首例nMOF介导的局部疗法,放射-放射动力治疗(RT-RDT),并向临床转化。在X射线照射下,作为节点的铪团簇能有效截流X射线,通过辐射解离(radiolysis)生成羟基自由基(Nat. Comms., 2018, 9 (1),2351),同时将能量转移到光敏配体如铱、钌等金属配合物(Nat. Comms., 2018, 9 (1),4321;J. Am. Chem. Soc., 2019, 141(17), 6859-6863)以及卟啉(Nat. Biomed. Eng. 2018, 2 (8), 600)上生成单线态氧。而相比于三维的纳米放疗增敏剂,单层的二维结构可以大大提高自由基的扩散效率,进一步提高放射-放射动力疗效(Angew. Chem. 2017, 129 (40),12270-12274; J. Am. Chem. Soc., 2019, 140 (49), 16971-16975)。纳米金属有机框架材料(nanoscale metal-organic framework, nMOF),作为一种新兴的分子纳米材料,因其自身的多孔性,结构规整性,后修饰方便,结构及组成可调性强等优点,近年来在纳米医学领域得到广泛关注。过去十多年里,芝加哥大学的林文斌课题组开拓了nMOF在纳米医学领域多个方向的应用,其中包括癌症诊断、药物载运与可控释放、光动力治疗与放射治疗等。在此基础上,林文斌课题组近几年开发出了一种新型纳的纳米金属有机单层(nanoscale metal-organic layer, nMOL)材料,将三维的nMOF的厚度降低到单层(<2nm), 极大提高原子利用率的同时,提高了药物的负载及活性氧物种的扩散,在生物传感与癌症治疗等领域具有广泛的应用前景。近日,林文斌课题组首次报道了基于直线型卟啉基桥连配体与重金属铪-氧团簇作为金属节点的nMOL用于增强放射-放射动力治疗并证明了nMOL增强的局部治疗可通过高效地引发免疫原性细胞死亡,提高肿瘤炎性,激活系统免疫,进而协同增强系统性免疫检查点阻断治疗。在具有肺转移能力的三阴性乳腺癌模型上,研究人员观察到联合疗法有效缓解脾脏肿大,进而发现联合治疗组可有效降低脾脏,骨髓与肺内的粒细胞型髓源抑制细胞(granulocytic myeloid-derived suppressor cells, gMDSCs),阻遏远端的间质-上皮转化过程(MET)从而抑制远端转移灶的形成。
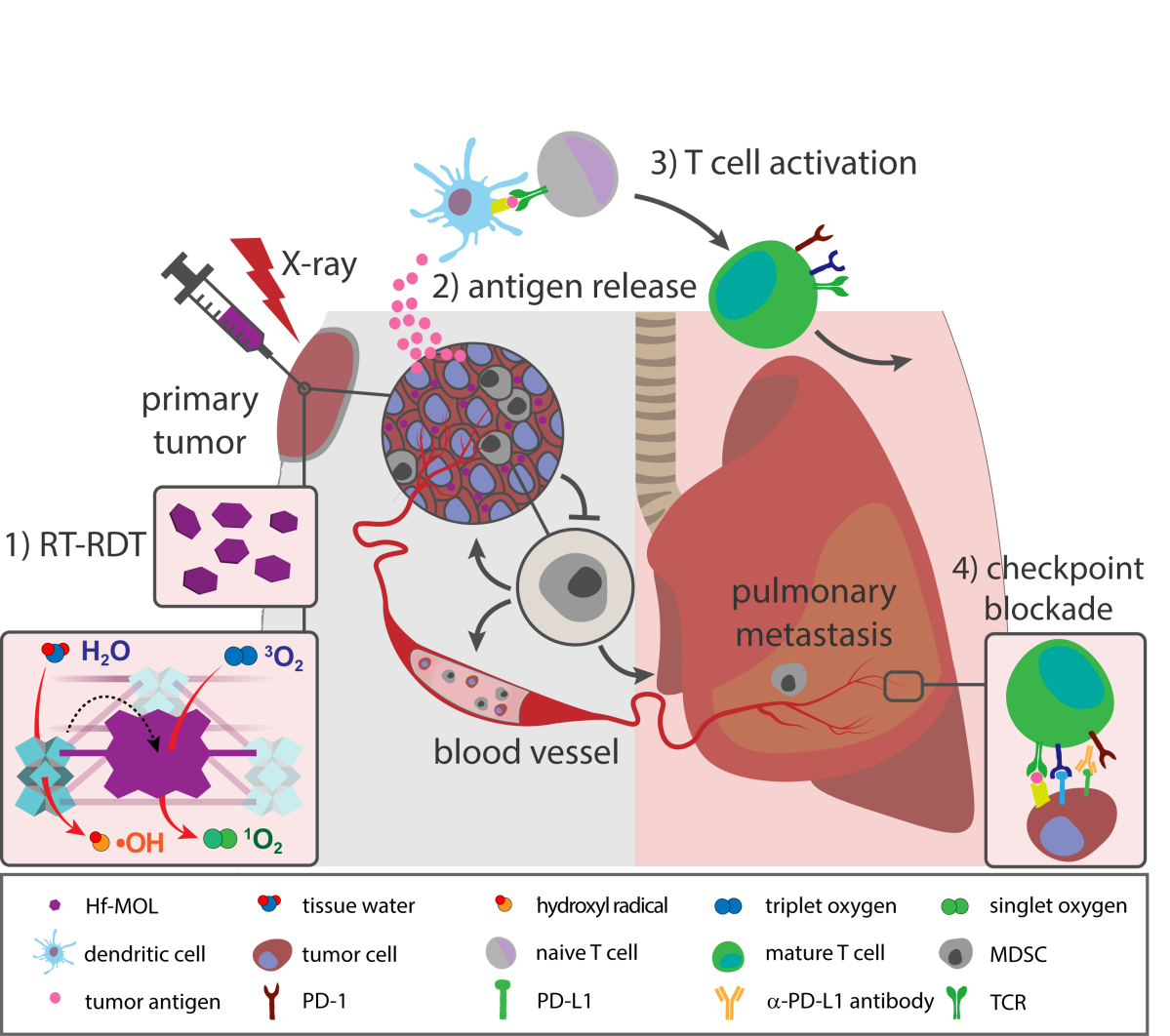
图1. 二维金属有机单层介导放射-放射动力治疗并结合免疫检测点阻断治疗实现抗癌症转移研究人员用溶剂热法将铪氧簇与直线型双羧酸的卟啉配体(DBP)组装合成,并通过调控温度和浓度等参数,得到具有单层结构的Hf-MOL。与之前报道的Hf-DBP nMOF(Hf-MOF)相比,高分辨透射电镜(HRTEM)与原子力显微镜(AFM)结果表明所合成Hf-MOL为直径~200 nm,高度约1.6nm的纳米单层,其厚度对应一个二级结构单元(secondary building unit, SBU)。而Hf-MOF为直径~100 nm、厚度为10~20nm的纳米板。SOSG谱图表明,在相同光照下,Hf-MOL比Hf-MOF生成了更多可检测的单线态氧,证明了单层结构可避免底物与产物的扩散限速从而提高自由基介导的局部疗效。
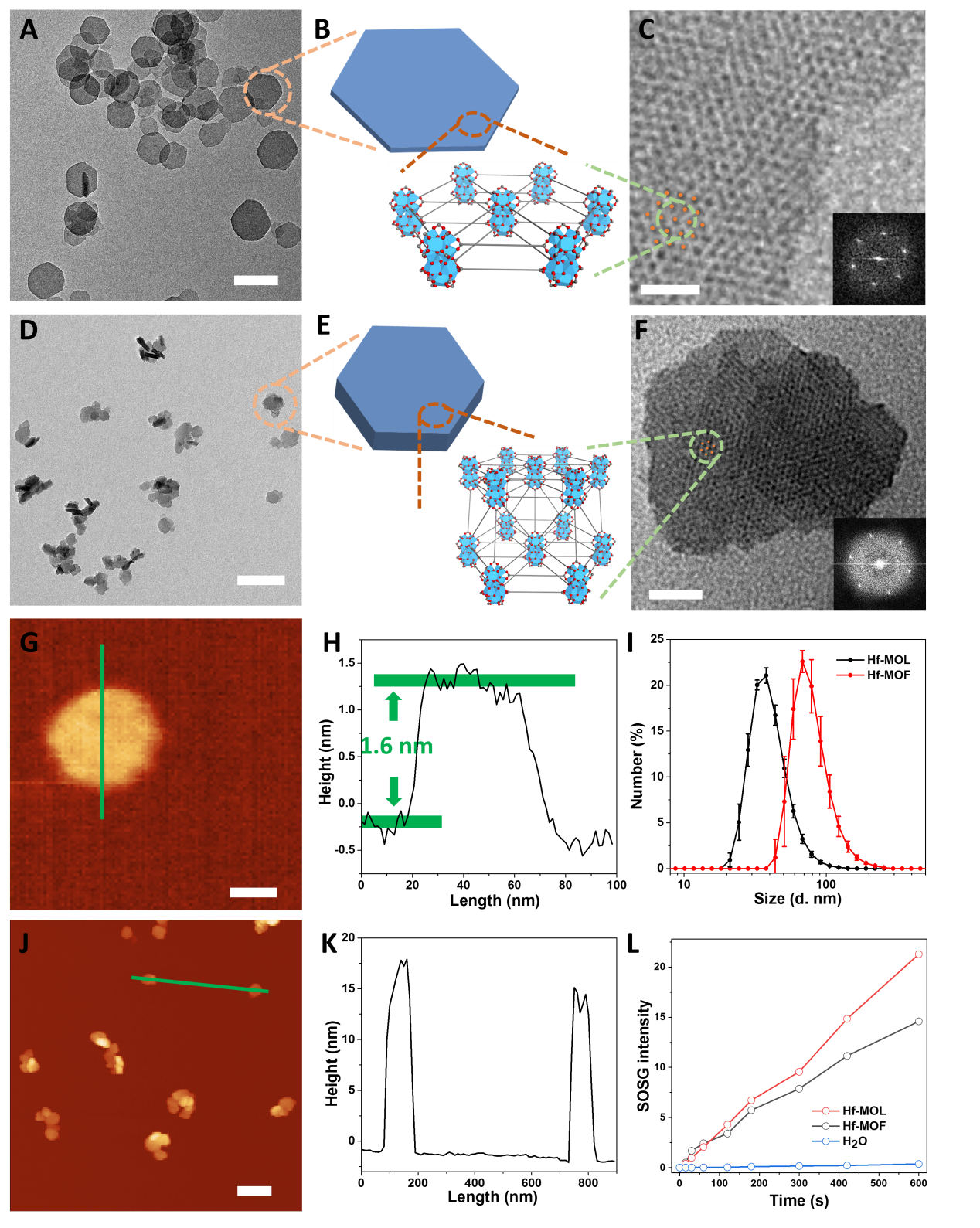
图2. Hf-MOL的形貌与结构表征。(A,B,C)Hf-MOL的TEM, 结构示意图,HRTEM与 FFT 图样。(A,B,C)Hf-MOF的TEM, 结构示意图,HRTEM与 FFT 图样。(G,H)Hf-MOL的原子力显微镜图像及高度剖面。(J,K)Hf-MOF的原子力显微镜图像及高度剖面。(I) Hf-MOL与Hf-MOF的动态光散射。(I) Hf-MOL与Hf-MOF的单线态氧产生。在证明Hf-MOL具有良好的生物环境稳定性后,一种具有相同SBU但不能生成单线态氧的nMOF, Hf-DBA,作为对照来评价Hf-MOL介导的RT-RDT疗效。在X射线(或伽马射线)照射下,相比于Hf-DBA,Hf-MOL具有更强的细胞急性毒性与长期抑制分裂能力。机理研究显示,Hf-MOL介导的RT-RDT通过单线态氧与羟基自由基两种活性氧物种实现辐射增强,破坏DNA双链,诱导细胞凋亡并抑制肿瘤侵袭。
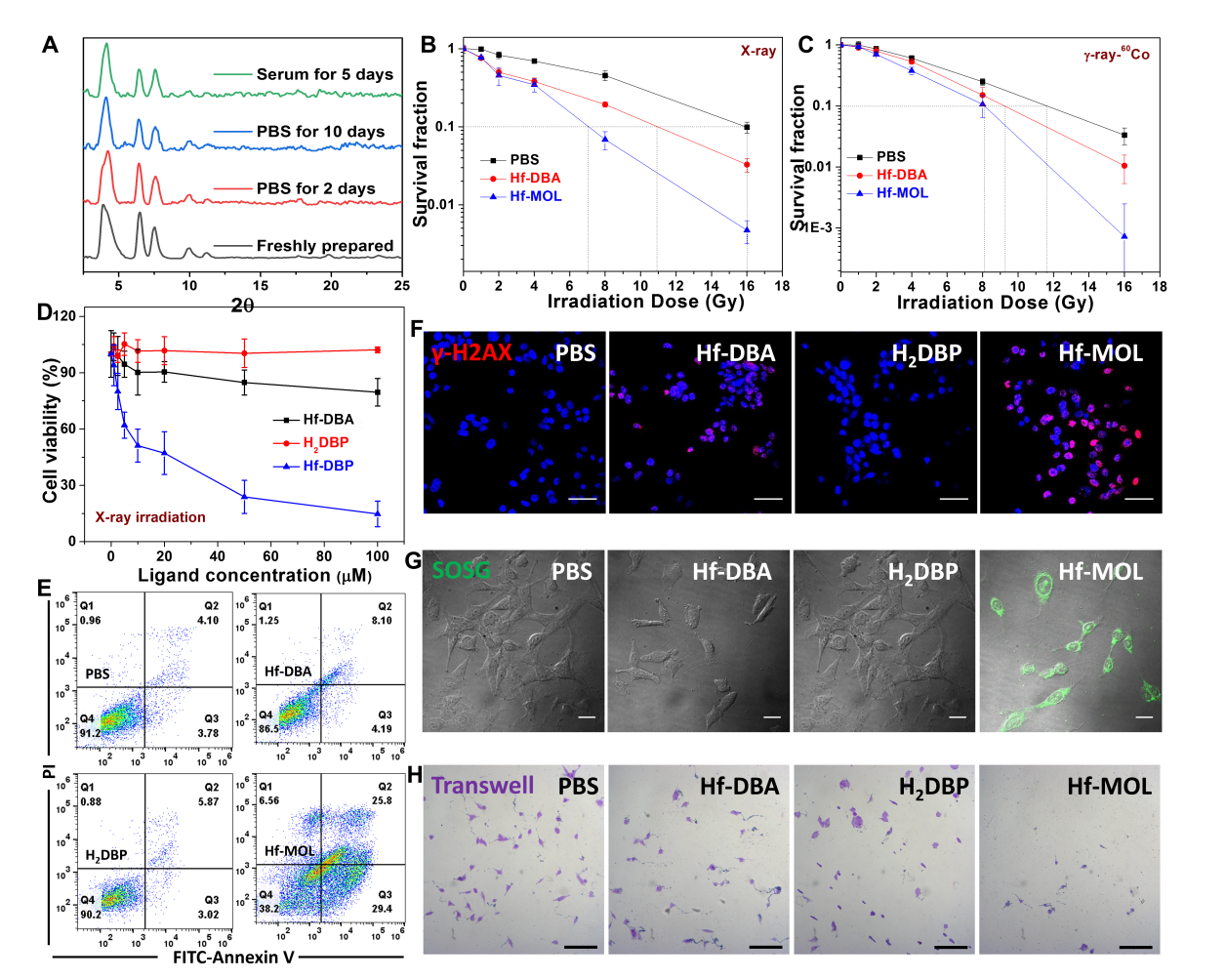
图3. Hf-MOL的RT-RDT。(A)Hf-MOL的稳定性测试。(B,C)X射线与伽马射线下Hf-MOL的群落生成实验。(D,E)X射线下Hf-MOL的细胞毒性、细胞凋亡。(F,G,H)X射线下的DNA双链断裂检测、单线态氧检测与细胞侵袭检测。要点3:评价Hf-MOL介导的RT-RDT的致免疫原性接着,研究人员评价了Hf-MOL介导的RT-RDT的致免疫原性。通过细胞层面上检测钙网蛋白(CRT),高迁移率族蛋白B1(HMGB-1)和三磷酸腺苷(ATP)三种指标,Hf-MOL介导的RT-RDT的致免疫原性显著高于nMOF介导的放疗。研究者将体外接受过RT-RDT治疗的三阴性乳腺癌细胞4T1注射到小鼠皮下,一周再在另一边注射正常活力的4T1细胞发现,RT-RDT处理过的4T1细胞使小鼠具备了4T1癌细胞的抗性。
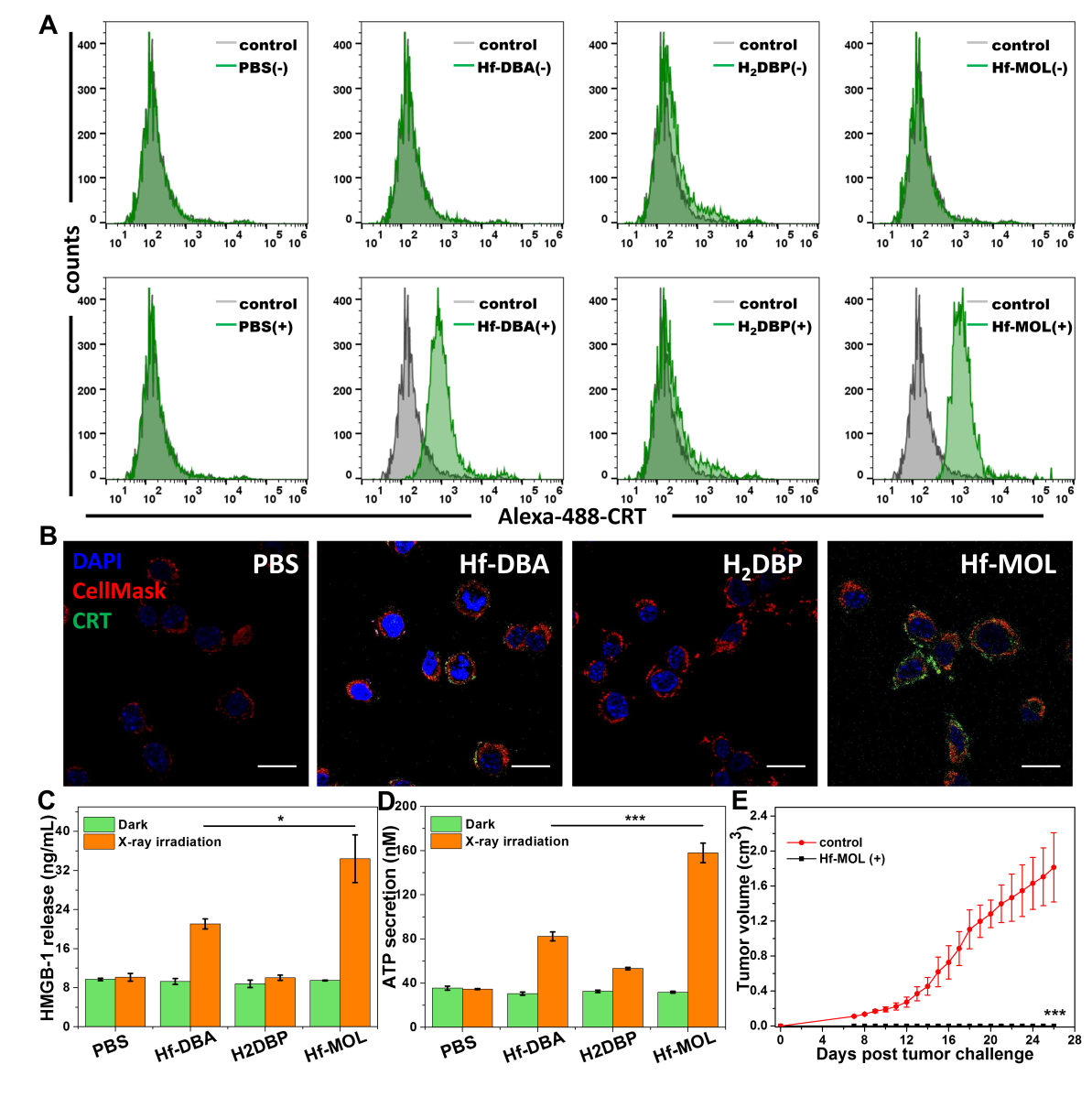
图4. Hf-MOL介导RT-RDT的致免疫原性。(A,B)流式细胞术与共聚焦显微成像检测CRT。(C,D)X酶联免疫检测HMGB-1与ATP的细胞释放。(E)接受癌症疫苗小鼠的肿瘤再刺激。要点4:Hf-MOL可协同PD-L1抗体实现全身性的抑制肿瘤与抗转移疗效在细胞层面证明之后,实验人员通过在Balb/c小鼠上构建伴肺部转移的原位三阴性乳腺癌模型来证明Hf-MOL可协同PD-L1抗体实现全身性的抑制肿瘤与抗转移疗效。研究人员仅对原位乳腺瘤给予Hf-MOL注射和X射线照射。实验发现,单独施加Hf-MOL介导的RT-RDT能有效的抑制原位肿瘤,但无法实现对远端转移的抑制;联用Hf-MOL介导的RT-RDT与PD-L1抗体介导的CBI与不仅能极大消除原位肿瘤,更能有效的抑制远端转移,实现了很好的远位效应。这些实验表明,Hf-MOL介导的放射-放射动力治疗联合抗PD-L1免疫检测点阻断疗法[Hf-MOL/-PD-L1(+)]能显著提高系统免疫响应,产生卓越的抗转移疗效。
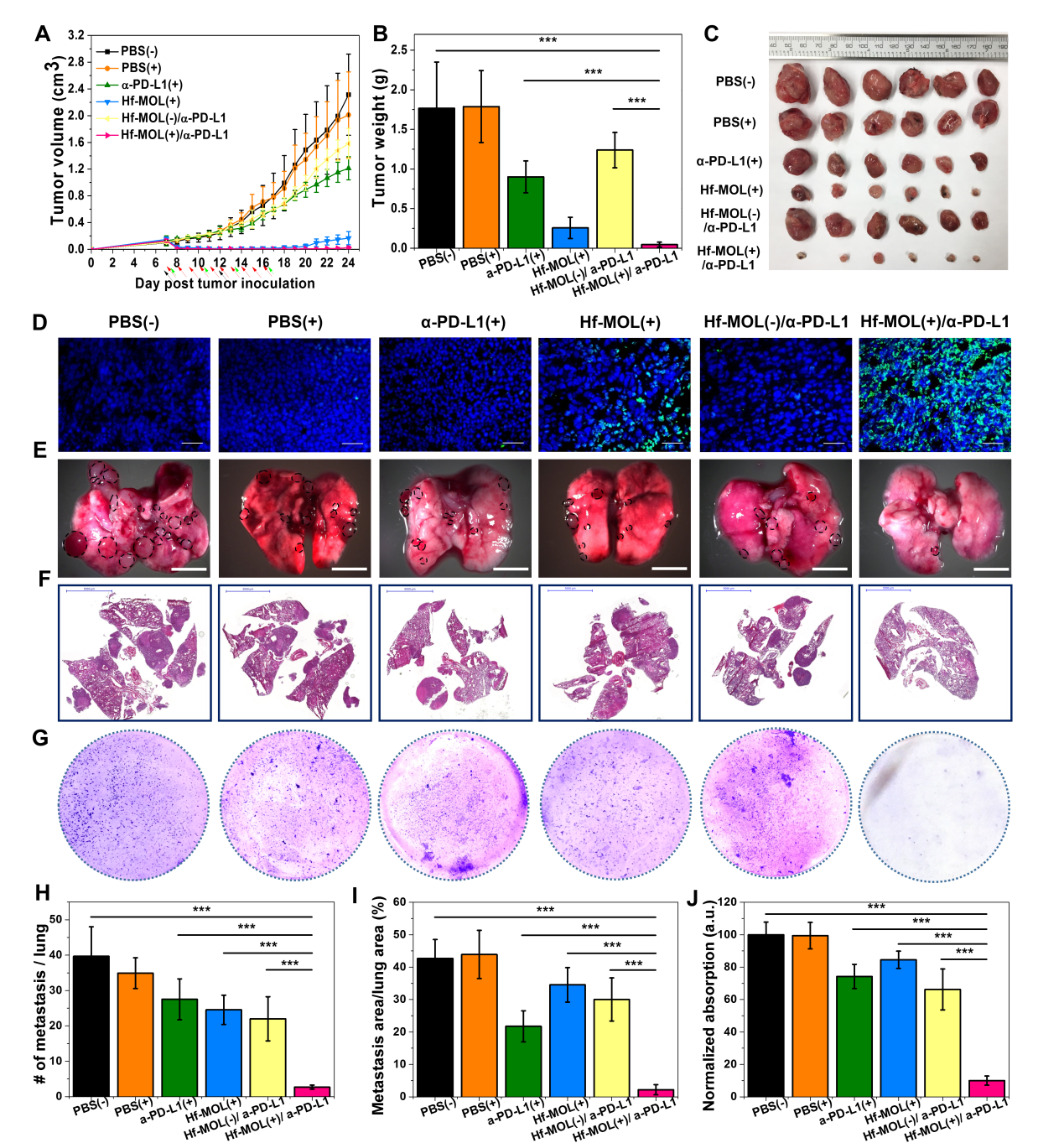
图5. Hf-MOL介导RT-RDT的抗癌疗效。(A,B,C)原位肿瘤生长、肿瘤照片与瘤重。(D)原位肿瘤的凋亡(TUNEL)切片免疫荧光染色。(E,F,G)肺部光学照片,H&E切片染色及克隆形成实验。研究人员针对联合治疗后肿瘤微环境中免疫细胞的浸润情况进行分析,流式细胞检测表明肿瘤中肿瘤特异性的效应T细胞、辅助T细胞,自然杀伤(NK)细胞以及B细胞上调,而肺中肿瘤特异性的效应T细胞、辅助T细胞,自然杀伤(NK)细胞上调。更多的抗肿瘤免疫细胞可被认为是肺部转移缓解的一个因素。在运用酶联免疫斑点技术(ELISpot)检测脾脏中肿瘤特异性IFN-的生成细胞时,研究人员发现未接受治疗的荷瘤鼠脾脏显著肿大,而接受联合治疗后脾脏恢复到正常水平。脾脏大小一般被认为是免疫响应强弱的象征,脾脏肿大被认为免疫急性毒性的表现。通过查阅文献,研究人员发现鼠源乳腺癌模型中,转移能力强的模型往往伴随脾肿大现象。这是因为脾脏中具有更多可促进MET过程的gMDSCs。因此研究人员研究了骨髓、脾脏与肺内免疫细胞的表型后发现,在联合治疗组中,骨髓与脾脏中gMDSCs显著性下调,说明系统性的免疫相应缓解了免疫抑制的同时减少了促进转移灶形成的gMDSCs。肺部降低的gMDSCs则直接支持了这一猜测。
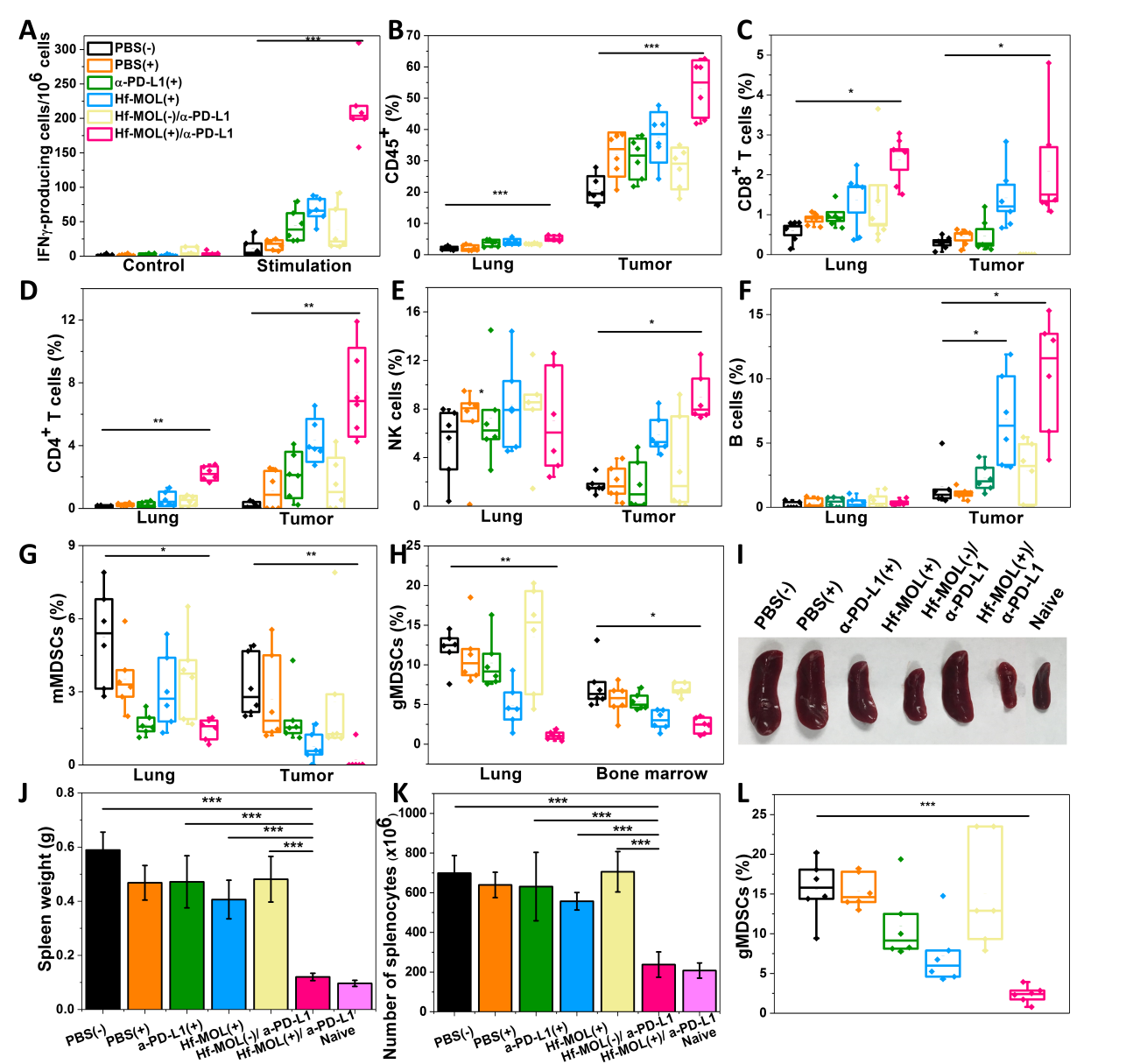
图6. Hf-MOL介导RT-RDT的抗癌及抗转移机理。(a) Hf-MOL/-PD-L1(+)治疗组中的肿瘤特异性IFN-分泌细胞上调。(B-F)CD45阳性、CD4阳性T与CD8阳性T细胞在Hf-MOL/-PD-L1(+)治疗组的原位瘤与肺中上调。(G,H)Hf-MOL/-PD-L1(+)治疗组中原位瘤与肺中MDSCs下调。(I.J,K)脾脏光学照片、脾重与脾脏细胞数量。(L)接受Hf-MOL/-PD-L1(+)治疗组小鼠脾脏中gMDSCs下调。综上所述,该工作报道了一种将系列铪基构成的nMOL用于增强放射-放射动力治疗并与免疫检测点阻断疗法联合作用用于抗肿瘤转移的新型疗法。Kaiyuan Ni, Guangxu Lan, Christina Chan, Xiaopin Duan,Nining Guo, Samuel S. Veroneau, Ralph R. Weichselbaum, Wenbin Lin. Ultrathin metal-organic layer-mediated radiotherapy-radiodynamic therapy enhances immunotherapy of metastatic cancers, Matter.2019.DOI: 10.1016/j.matt.2019.06.007https://www.sciencedirect.com/science/article/pii/S2590238519300591

林文斌,美国芝加哥大学化学系和辐射与细胞肿瘤系的James Franck讲座教授。林文斌教授在化学与生物化学及纳米医学方面有重要贡献,在包括Nat. Biomed. Eng.,Nat. Chem.,J. Am. Chem. Soc.,Angew. Chem. Int. Ed. 等世界顶级杂志上发表文章350余篇,文章被广泛引用(h-index >100)。1999-2009 年度文章引用世界前十位化学家。汤森路透集团2000-2010年全球顶尖一百化学家名人堂榜单第54名。林文斌团队研发的三个抗癌药物已在进行临床试验并取得良好的初步结果。https://www.x-mol.com/university/faculty/1445http://linlab.uchicago.edu/