通讯作者:Jesús Santamaría ,Asier Unciti-Broceta
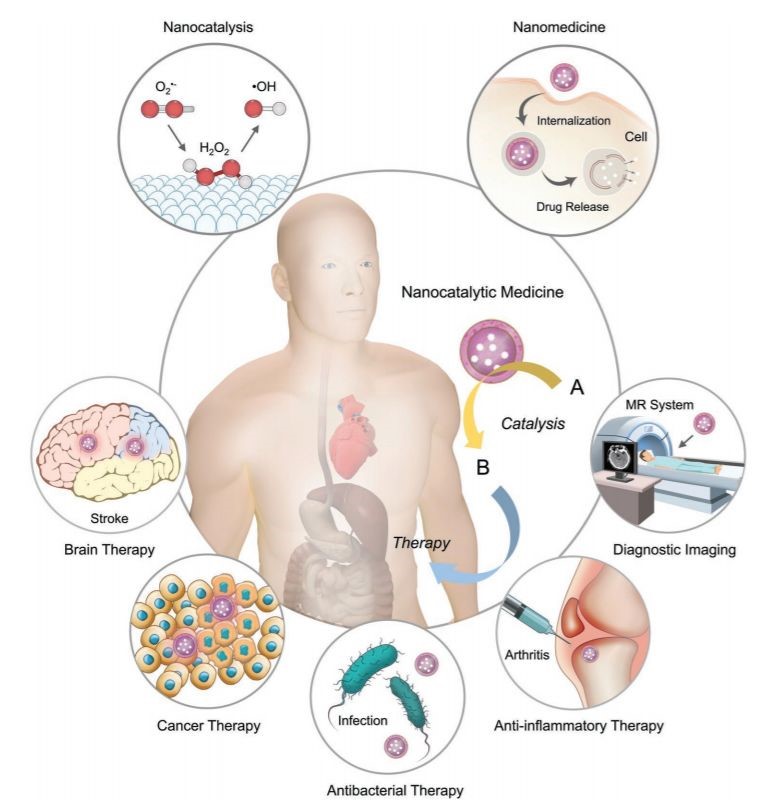
自从2012年CeO2纳米催化剂被用于缺血性中风研究以来至今的八年时间里,纳米催化剂已经逐渐攻入生物医学领域,两者相互合作,取得了不少突破性进展。纳米催化医学作为一门交叉研究领域,正在吸引科学家的广泛关注。
参考文献:Bowen Yang, Yu Chen, Jianlin Shi. et al. Nanocatalytic Medicine. Advanced Materials. 2019. DOI: 10.1002/adma.201901778https://onlinelibrary.wiley.com/doi/10.1002/adma.201901778
在纳米催化医学领域,Pd纳米催化剂似乎独具特色,颇受欢迎。而生物正交化学的蓬勃发展使得在体内利用非自然的手段合成具有生物活性的材料成为了现实。由于金属钯(Pd)催化可以通过在生物系统中产生异源物质并释放功能化生物分子,因此其在生物正交催化这一领域也发挥了重要的作用其中。然而由于受到诸多因素和条件的限制,相对于快速发展的催化剂来说,如何有选择性地将催化剂靶向递送给特定的细胞却仍然进展缓慢。
有鉴于此,西班牙萨拉戈萨大学Jesús Santamaría团队和英国爱丁堡大学Asier Unciti-Broceta团队合作开发了一种基于二维Pd纳米片催化剂的人工生物材料,实现了靶向生物正交催化治疗肿瘤!
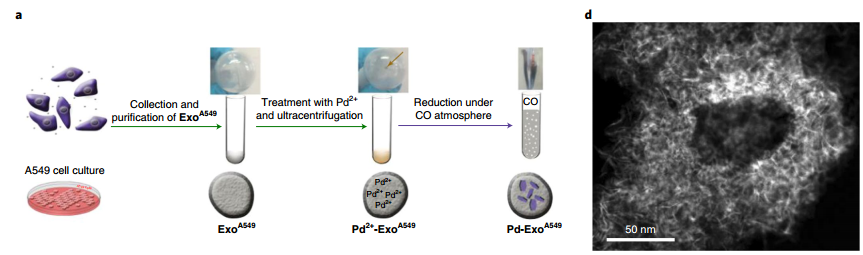
图1. 利用A549癌细胞构建Pd-EXOA549的示意图
该材料是由癌症细胞衍生的外泌体和超薄的Pd纳米片催化剂所组成,并可以对负载的Pd纳米片的组装进行直接控制。这一杂交体系材料既可以完成由Pd催化剂诱导的细胞内和体外的脱烷基反应,也对其祖细胞具有出优先的靶向性。这种利用“特洛伊木马式”的外泌体载体来将非生物的催化剂靶向递送至指定的癌细胞的策略也为设计新的靶向治疗模式提供了有效的辅助策略。
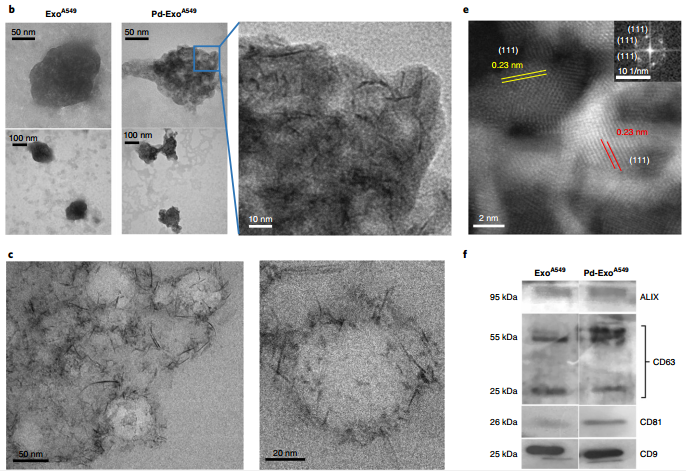
图2. EXOA549和Pd-EXOA549的TEM表征及生物标志物分析
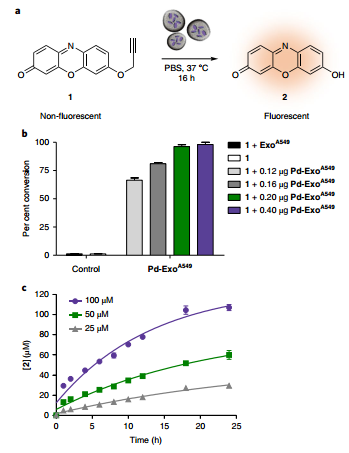
这一研究所开发的纳米生物混合材料Pd-Exo可将外泌体的靶向能力和生物正交化学充分结合,通过利用可直接囊泡内生成的超薄Pd纳米片作为催化剂,在保持了Pd纳米结构催化活性的同时也发挥了外泌体载体的靶向功能。因此它也为实现将金属结构导入生物囊泡的生物正交过程提供了一个经典的范例。
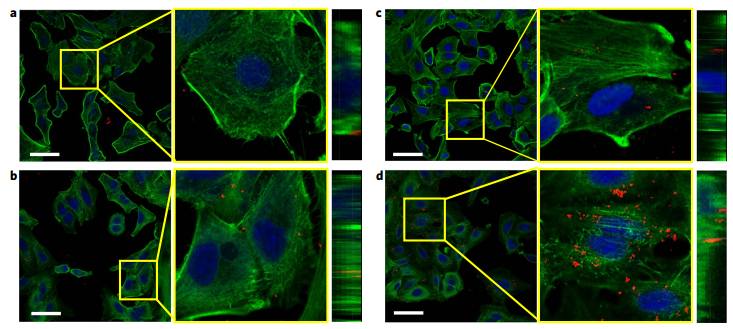
图4. 共聚焦实验说明Pd-EXOA549可被A549癌细胞有效地内化,从而为实现靶向治疗奠定良好的基础
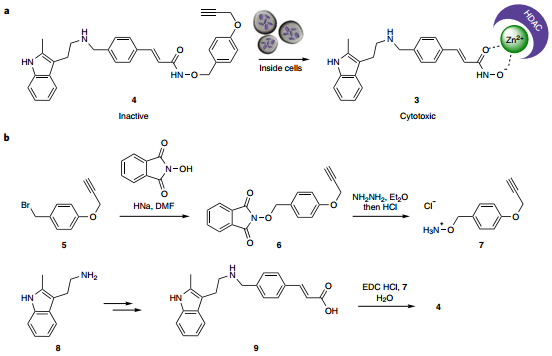
并且,Pd-Exo不仅具有靶向癌细胞并进行生物正交反应的能力,而且还可以对不同类型的细胞进行有效区分。同一种前药会被不同的Pd-Exo激活而产生特异性细胞毒性,充分说明了这种结合外泌体介导的催化剂递送和生物正交化学的策略具有非常好的以时空选择性的方式激活生物活性物质的应用价值。
图5. 实验在A549和U87肿瘤细胞中证明了Pd-EXOA549和Pd-EXOU87可以有效介导前药的胞内活化,实现靶向治疗
总之,这一研究发展了基于外泌体介导的纳米催化药物靶向递送和生物正交化学的策略,为纳米催化医学的发展提供了全新的思路。
MaríaSancho-Albero, Belén Rubio-Ruiz, Jesús Santamaría,* Asier Unciti-Broceta,* etal. Cancer-derived exosomes loaded with ultrathin palladium nanosheets fortargeted bioorthogonal catalysis. Nature Catalysis.2019DOI:10.1038/s41929-019-0333-4https://www.nature.com/articles/s41929-019-0333-4