1. Nat. Rev. Cancer:利用纳米技术改善癌症免疫治疗
利用患者的免疫系统来对抗肿瘤的癌症免疫治疗在2018年获得了诺贝尔生理学或医学奖,其效用也已在临床得到了充分的验证。但是,目前对免疫治疗有着良好响应的患者比例却仍然很低(约为15%)。这是因为肿瘤有着多种的免疫逃避的机制。而通过对免疫系统进行时空调控则有望实现最佳的治疗效果。
纳米颗粒和其他一些生物材料可以对免疫调节试剂的靶向位置、药代动力学和协同递送进行调整,因此将癌症免疫治疗和纳米生物工程等技术进行融合是一种非常好的策略。丹娜-法伯癌症研究所Michael S. Goldberg教授对用于改善癌症免疫治疗的相关纳米技术研究进行了综述,并对这一领域的发展方向做了详细介绍。
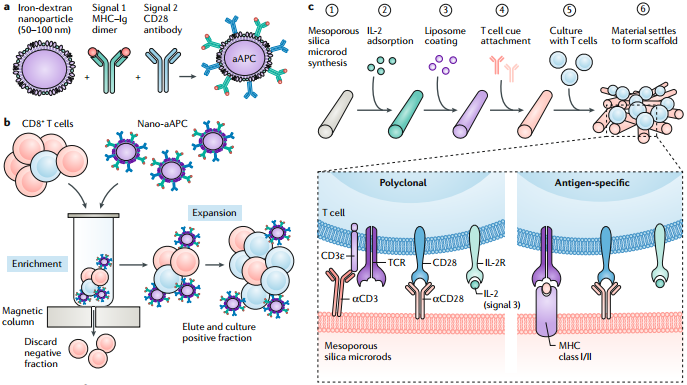
Michael S. Goldberg. Improving cancer immunotherapy through nanotechnology. Nature Reviews Cancer. 2019
https://www.nature.com/articles/s41568-019-0186-9
2. AM综述:用于个性化细胞治疗的生物材料
细胞疗法为治疗顽固性疾病提供了一种新的方法,例如用于组织再生的间充质干细胞、用于糖尿病治疗的胰岛移植和用于癌症免疫治疗的T细胞递送等。而生物材料可以作为载体来维持细胞的存活和功能,并增强细胞治疗的效果。随着个性化医疗迅速发展,细胞疗法也被证明其在这一领域具有巨大的应用潜力。
它可以通过使用患者特异性细胞或生物材料来指导细胞活动,以满足每个患者的需要,从而实现个性化医疗。麻省理工学院Daniel G. Anderson教授团队综述了生物材料在组织再生、治疗蛋白递送和癌症免疫治疗中的作用,并重点介绍了用于个性化细胞治疗的生物工程材料的性能及相关研究进展。
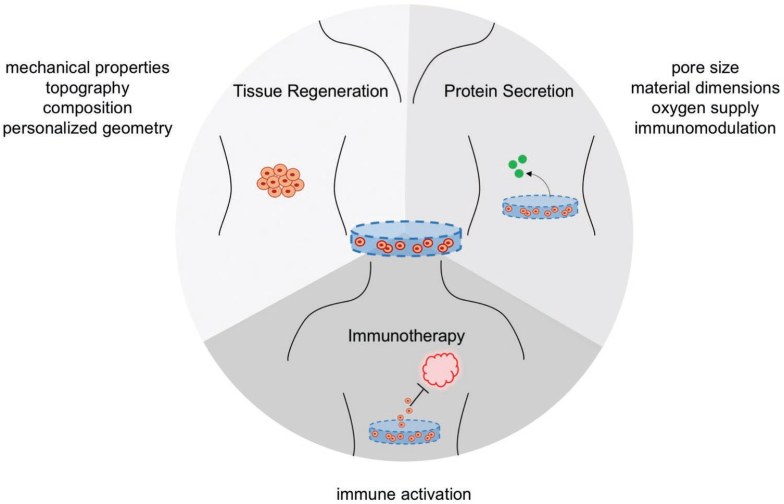
Amanda L. Facklam, Daniel G. Anderson. et al. Biomaterials for Personalized Cell Therapy. Advanced Materials. 2019
DOI: 10.1002/adma.201902005
https://onlinelibrary.wiley.com/doi/10.1002/adma.201902005
3. AFM综述:用于靶向转移瘤的细胞基纳米系统
癌症发生转移是癌症造成死亡的重要原因之一。目前,已有多种细胞基纳米系统(CBNs)被开发出来用于靶向转移瘤并进行药物递送,这些CBNs可以将源细胞和纳米颗粒的优点相结合。
中科院上海药物研究所张志文研究员和李亚平研究员合作,综述介绍了对用于治疗肿瘤转移的CBNs的相关研究;对针对于肿瘤转移的不同阶段,如原发性肿瘤、循环肿瘤细胞(CTCs)、远处转移以及肿瘤免疫微环境(TIM) 的CBNs进行了讨论;并就如何设计CBNs以提高肿瘤转移治疗过程中的药物递送效率提出了一些可行的观点。
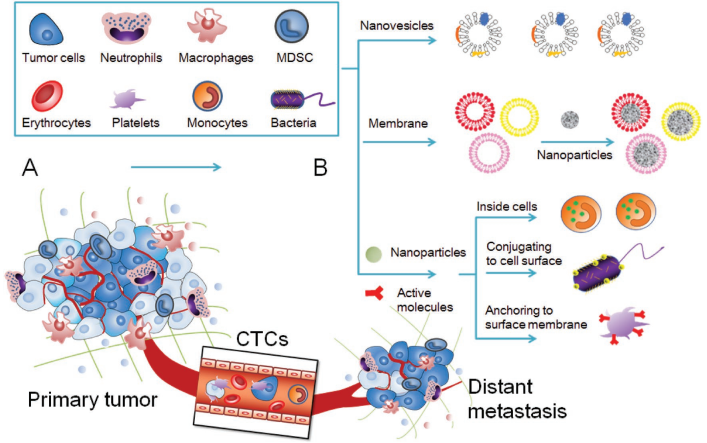
Xiang Gong, Zhiwen Zhang, Yaping Li. et al. Emerging Approaches of Cell-Based Nanosystems to Target Cancer Metastasis. Advanced Functional Materials. 2019
DOI: 10.1002/adfm.201903441
https://onlinelibrary.wiley.com/doi/10.1002/adfm.201903441
4. AM综述:设计用于胞内递送蛋白的纳米载体
与小分子药物相比,利用蛋白质或抗体进行的疗法可以在极低的浓度下也保持高特异性和高活性,但它也存在着结构脆弱、分子尺寸大和膜穿透性差等缺点。而为了这些问题,各种用于负载蛋白质的纳米载体,如脂质纳米胶囊,聚合物纳米颗粒,无机纳米颗粒和多肽等都被开发出来。
新加坡国立大学Shao Q. Yao教授、南京工业大学李林教授和黄维院士合作综述了不同的胞内递送蛋白质的策略;对设计路线、作用机制和治疗方法进行了详细讨论;最后对这一领域的发展前景进行了展望。
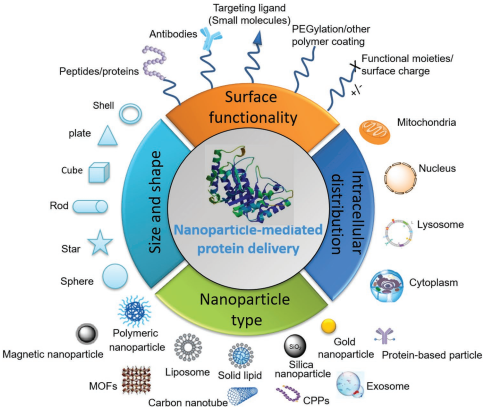
Xiaofei Qin, Shao Q. Yao, Wei Huang. et al. Rational Design of Nanocarriers for Intracellular Protein Delivery. Advanced Materials. 2019
DOI: 10.1002/adma.201902791
https://onlinelibrary.wiley.com/doi/10.1002/adma.201902791
5. AM:人造的自然杀伤细胞用于特异性肿瘤抑制和巨噬细胞再教育
自然杀伤(NK)细胞不仅能识别和消除异常细胞,还能对免疫细胞进行募集和再教育以保护宿主。然而,NK细胞的功能在免疫抑制的肿瘤微环境(TME)中往往会受到限制。武汉大学张先正教授团队设计了一种人造的NK细胞(aNK),TME对aNK的限制作用很低,且它可以对巨噬细胞进行再教育以抑制肿瘤。实验利用血红细胞膜(RBCM)去包裹全氟正己烷(PFC)和葡萄糖氧化酶(GOX)构建了aNK。
Ank可通过消耗葡萄糖和生成过氧化氢(H2O2)来直接杀死肿瘤细胞。并且生成的H2O2也可作为细胞因子和趋化因子来募集免疫细胞,并对存活的巨噬细胞进行再教育,使其攻击肿瘤细胞。此外,载氧的PFC可以增强GOX的催化反应,改善乏氧的TME。体内外实验结果表明, aNK具有很好的肿瘤抑制和免疫激活作用。
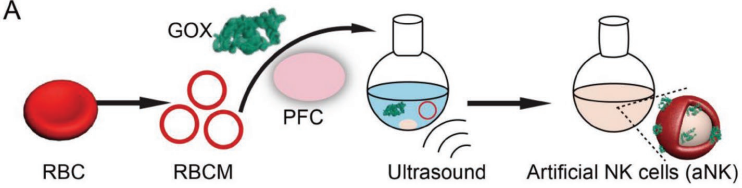
Mei-Zhen Zou, Xian-Zheng Zhang. et al. Artifcial Natural Killer Cells for Specific Tumor Inhibition and Renegade Macrophage Re-Education. Advanced Materials. 2019
DOI: 10.1002/adma.201904495
https://onlinelibrary.wiley.com/doi/10.1002/adma.201904495
6. AFM:Au-SiO2-WO3核壳纳米粒子用于表面增强拉曼光谱和细胞成像
随着纳米技术的快速发展,在纳米尺度上检测和控制单个物体并用于生物医学已成为可能。在癌症成像中,纳米粒子(NPs)也具有识别单个癌细胞和精确标记更大面积癌组织的能力。
英国埃克塞特大学朱艳秋教授团队报道了一种Au-SiO2-WO3纳米粒子,它的表面增强拉曼散射(SERS)的增强因子可达103,对于硅晶实验结果表明,具有出色SERS增强功能的Au-SiO2-WO3在单分子检测、细胞相容性和利用相干反斯托克斯-拉曼散射进行的体外细胞成像方面具有显著的优势。
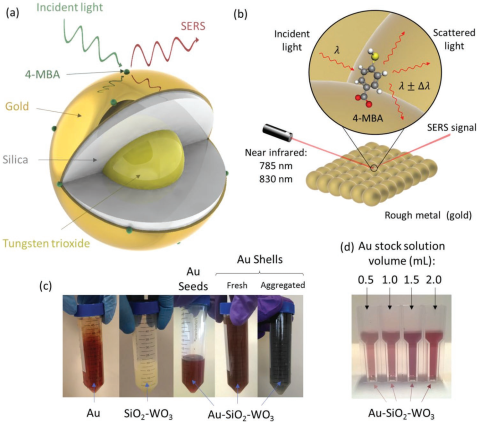
Pablo Martinez Pancorbo, Yanqiu Zhu. et al. Novel Au–SiO2–WO3 Core–Shell Composite Nanoparticles for Surface-Enhanced Raman Spectroscopy with Potential Application in Cancer Cell Imaging. Advanced Functional Materials. 2019
DOI: 10.1002/adfm.201903549
https://onlinelibrary.wiley.com/doi/10.1002/adfm.201903549
7. Nature. Nanotech.:可肾清除的催化性金纳米簇用于体内疾病监测
超小金纳米团簇(AuNCs)具有很好的肿瘤富集和可被肾脏清除等特性,已经成为一种用于体内成像的灵敏探针。然而,目前还没有研究去利用AuNCs的催化活性来实现体内传感。麻省理工学院Sangeeta N. Bhatia教授和伦敦帝国理工学院Molly M. Stevens教授合作,利用具有类过氧化物酶活性和可被肾脏代谢的AuNCs构建了一种多功能蛋白酶纳米传感器,它可以对疾病微环境做出响应,从而在不到一小时的时间内产生比色信号读数并对疾病状态进行监测分析。
实验通过收集比较结直肠癌小鼠和正常小鼠尿液中AuNCs的催化活性,发现肿瘤小鼠比健康小鼠的比色信号增加了13倍。并且该纳米传感器在被注射后4周内会通过肝、肾而完全代谢,不会产生体内毒性。
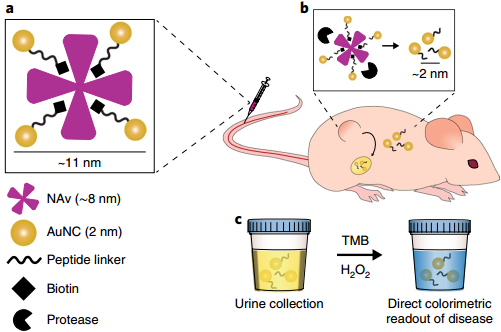
Colleen N. Loynachan, Sangeeta N. Bhatia, Molly M. Stevens. et al. Renal clearable catalytic gold nanoclusters for in vivo disease monitoring. Nature Nanotechnology. 2019
https://www.nature.com/articles/s41565-019-0527-6
8. Adv. Sci.:类蒲公英的纳米颗粒用于肿瘤微环境调节
肿瘤相关巨噬细胞(TAMs)占肿瘤细胞总数的50%以上,在肿瘤的发展和侵袭转移中起着重要的作用。因此,通过调节TAM发生极化来重建肿瘤免疫微环境已成为一种新的治疗策略。然而,这一策略也面临着无法在肿瘤中充分渗透的问题。复旦大学蒋晨教授团队设计了一种可被酸诱导产生尺寸变化的纳米颗粒Apt@(DGL-ZA)n NPs,它具有良好的肿瘤分布和增强的穿透能力。其中,树突状移植物多聚赖氨酸(DGLs) 是一种模拟天然异常蛋白的分子,可诱导肿瘤自噬,实验通过一种温和的酸响应连接剂将其交联在NPs上。
因此该NPs在中性pH条件下可以抓住DGLs,而在肿瘤pH条件下会释放DGLs,这种类似于蒲公英种子的行为特性使得NPs具有很长的体内循环和增强的肿瘤穿透性。实验进一步将用来调节巨噬细胞的唑来膦酸(ZA)通过电荷吸引作用负载在DGLs上,最后通过修饰靶向肌腱蛋白- C的适配体GBI-10以实现肿瘤富集。体内外实验结果表明,Apt@(DGL-ZA)n NPs在肿瘤组织中具有较强的穿透性,可以有效地对巨噬细胞进行调控并增强肿瘤自噬,从而实现良好的体内抗肿瘤效果。
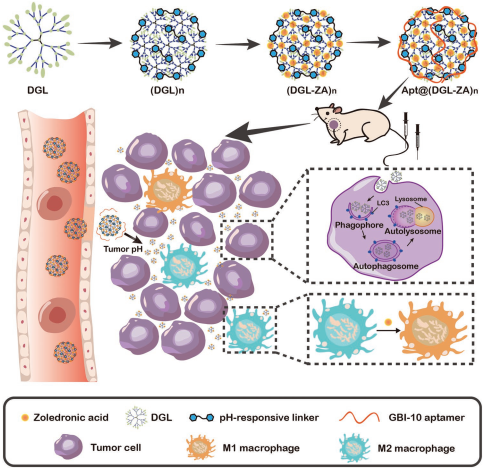
Qin Guo, Chen Jiang. et al. Dandelion-Like Tailorable Nanoparticles for Tumor Microenvironment Modulation. Advanced Science. 2019
DOI: 10.1002/advs.201901430
https://onlinelibrary.wiley.com/doi/full/10.1002/advs.201901430
9. Nano Lett.:偶联适配体的核酸骨架材料用于治疗脑缺血再灌注损伤
如何保护濒死神经元免受脑缺血再灌注损伤(IRI)是治疗缺血性中风所面临的一个重大难题。而氧化应激和炎症是导致IRI的主要原因。其中,C5a是加剧氧化应激与炎症反应之间恶性循环的罪魁祸首之一。威斯康星大学麦迪逊分校Dawei Jiang博士和蔡伟波教授合作制备了一种与抗C5a适配体(aC5a)偶联的核酸骨架 (FNA),它可以有选择性地降低c5a介导的神经毒性,并有效缓解脑内氧化应激。
实验采用鞘内注射aC5a-FNA的方式对缺血性中风大鼠进行治疗,并利用PET成像技术对aC5a-FNA在缺血性半影区的积累情况及治疗效果进行了研究。结果表明,aC5a-FNA在发生脑缺血再灌注后能快速穿透不同的脑区,并能有效保护神经元免受脑缺血再灌注损伤。
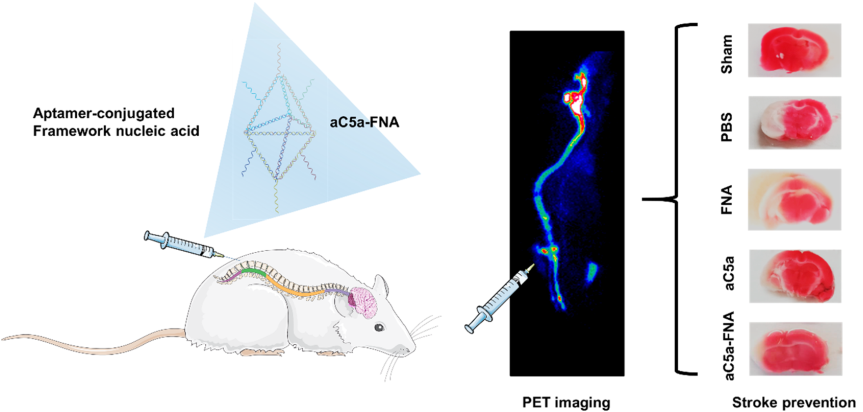
Shiyong Li, Dawei Jiang, Weibo Cai. Aptamer-Conjugated Framework Nucleic Acids for the Repair of Cerebral Ischemia-Reperfusion Injury. Nano Letters. 2019
DOI: 10.1021/acs.nanolett.9b02958
https://pubs.acs.org/doi/10.1021/acs.nanolett.9b02958
10. ACS Nano:源于肿瘤的细胞外囊泡可通过胞吞作用穿过完整的血脑屏障
血脑屏障(BBB)的存在给实现脑部药物递送造成了很大的困难,目前的纳米药物也都缺乏可以跨越血脑屏障的能力。已有研究表明,细胞外囊泡(EVs)对包括转移性脑癌在内的多种脑部疾病的发展起重要作用,因此也被认为是一种很有前途脑部药物递送载体。但人们对于肿瘤源性的EVs破坏血脑屏障的能力及其机制尚不清楚。
波士顿儿童医院Marsha A. Moses团队证明了肿瘤源性的EVs可以在体内破坏完整的BBB,并且确定了胞吞作用是这一过程背后的主要机制。实验也利用高时空分辨率的显微镜证明了内皮细胞的内吞循环通路会参与这种细胞外转运。这一研究工作表明,肿瘤源性的EVs可以在体内破坏完整的BBB,这也为实现向脑部递送药物和脑部疾病治疗提供了新的策略。
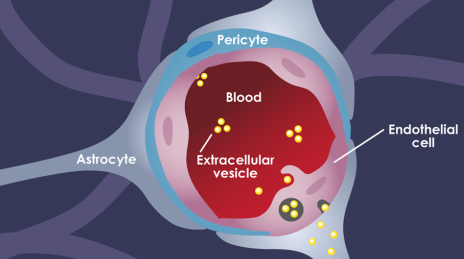
Golnaz Morad, Marsha A. Moses. et al. Tumor-Derived Extracellular Vesicles Breach the Intact Blood−Brain Barrier via Transcytosis. ACS Nano. 2019
DOI: 10.1021/acsnano.9b04397
https://pubs.acs.org/doi/10.1021/acsnano.9b04397
11. Nano Lett.:将病毒光粒子转化为靶向肿瘤的纳米载体用于药物递送
从子代病毒中分离出来的溶瘤病毒光纳米粒子(L-particles)是由病毒的包膜和一些被膜蛋白组成的,不含有核蛋白壳。非感染性的L-particles与成熟的溶瘤病毒粒子经历了相同的内化过程,是一种很好的靶向诊疗平台。然而,由于缺乏有效的方法,目前基于L-particles的诊疗平台还很少见。
武汉大学庞代文教授团队提出了一种可以将L-particles转化为近红外(NIR)荧光Ag2Se量子点(QD)标记的肿瘤靶向纳米载体的方法,并将其用于实时原位成像和药物递送。实验采用电穿孔技术将近红外荧光Ag2Se量子点标记到L-particles上,标记效率约为85%,而负载抗肿瘤药物的效率约为87%。实验结果表明,病毒L-particles可以在不被进一步修饰的情况下识别并进入肿瘤细胞,因此可以作为一种主动靶向肿瘤的纳米诊疗平台。
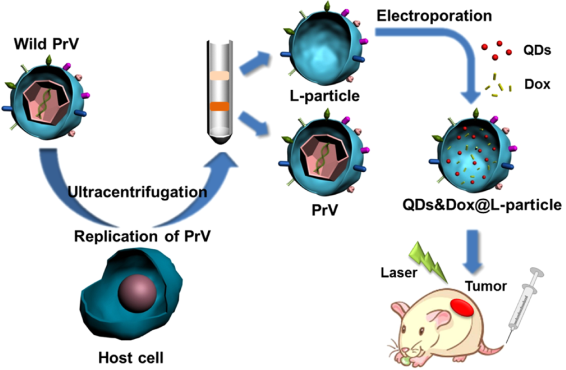
Cheng Lv, Dai-Wen Pang. et al. Transformation of Viral Light Particles into Near-Infrared Fluorescence Quantum Dot-Labeled Active Tumor-Targeting Nanovectors for Drug Delivery. Nano Letters. 2019
DOI: 10.1021/acs.nanolett.9b02483
https://pubs.acs.org/doi/10.1021/acs.nanolett.9b02483
12. Adv. Sci.:Janus纳米子弹用于增强协同的抗肿瘤转移免疫疗法
光动力疗法(PDT)可以有效治疗原发性肿瘤,但对远处的转移瘤往往无效。大连理工大学孙文博士和中科院苏州生物医学工程技术研究所董文飞研究员合作,利用免疫原性纳米颗粒介导的联合PDT和磁热治疗来协同增强抗肿瘤转移的免疫疗法。
实验利用肿瘤细胞膜对该Janus纳米子弹进行包裹得到M-MONs@Ce6,它具有良好的肿瘤靶向效果和较长的血液循环时间。结果表明,PDT和磁热疗法相结合后具有很强的协同抗癌活性,并会引发免疫原性细胞死亡,从而产生肿瘤特异性免疫反应。在进一步结合抗CTLA-4抗体后,该仿生纳米颗粒可显著清除原发和转移性肿瘤。
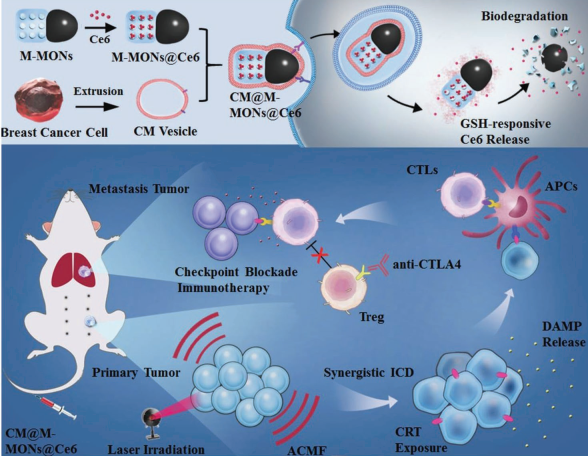
Zheng Wang, Dan Shao, Wen Sun, Wen-Fei Dong. et al. Janus Nanobullets Combine Photodynamic Therapy and Magnetic Hyperthermia to Potentiate Synergetic Anti-Metastatic Immunotherapy. Advanced Science. 2019
DOI: 10.1002/advs.201901690
https://onlinelibrary.wiley.com/doi/10.1002/advs.201901690
13. AM综述:3D打印技术在精准医学中的应用
数据分析、基因组学和影像学等技术的进步大大推动了精准医学的发展,可以有效地针对个体患者实现个性化治疗。而3D打印技术可通过设计具有个性化形状、结构和材料的精准可植入材料或开发具有患者特异性的体外模型来实现精准医学。宾夕法尼亚大学Jason A. Burdick教授团队对关于3D打印技术的最新研究进展及其在精准医学领域的应用进行了详细综述,并对这一领域所面临的挑战和发展前景进行了介绍。
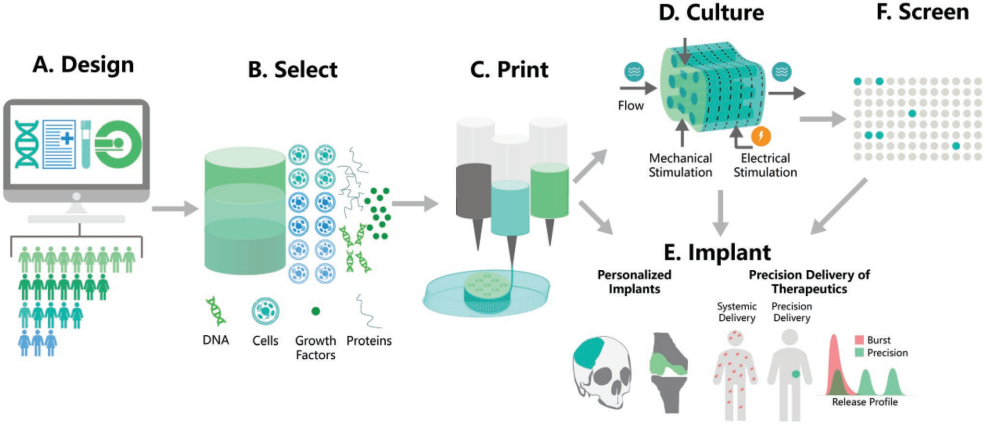
Margaret E. Prendergast, Jason A. Burdick. et al. Recent Advances in Enabling Technologies in 3D Printing for Precision Medicine. Advanced Materials. 2019
DOI: 10.1002/adma.201902516
https://onlinelibrary.wiley.com/doi/10.1002/adma.201902516
14. ACS Nano:仿生磁性纳米结构用于针对淋巴瘤的诊断治疗应用
B-细胞淋巴瘤细胞依靠胆固醇维持着增殖和生存信号,因此对淋巴瘤细胞进行靶向的胆固醇消耗是一种很有潜力的治疗策略。美国西北大学Vinayak P. Dravid教授团队制备了一种仿生高密度脂蛋白磁性纳米结构(HDL-MNSs),它可以结合具有高亲和力的HDL受体和清除剂受体B1 (SR-B1),进而消耗肿瘤细胞的胆固醇。
而MNS的内核可以在外部射频场下产生热量,诱导热休克蛋白的表达从而激活抗原呈递细胞,进而实现适应性的抗肿瘤免疫反应。研究通过多种方式证明了S HDL-MNSs具有细胞特异性的靶向效果,可以有效地消耗胆固醇并诱导热激活介导的抗肿瘤免疫反应,同时也具有很好的MRI成像性能,是一种很好的针对于淋巴瘤的诊疗平台。
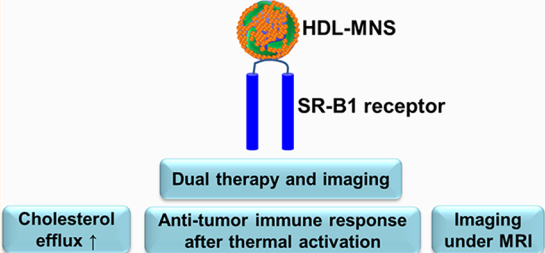
Abhalaxmi Singh, Vinayak P. Dravid. et al. Biomimetic Magnetic Nanostructures: A Theranostic Platform Targeting Lipid Metabolism and Immune Response in Lymphoma. ACS Nano. 2019
DOI: 10.1021/acsnano.9b03727
https://pubs.acs.org/doi/10.1021/acsnano.9b03727
15. Small:内源性H2S触发Au@Cu2O实现增强的光声成像和光热治疗
可被内源性H2S触发的智能诊疗试剂可以通过结合光声成像和光热治疗来提高对结肠癌的诊断和治疗效果。然而,目前这些试剂在被H2S触发后的诊疗性能往往很低,这也大大限制了它们的进一步应用。
上海师范大学田启威博士和杨仕平教授合作研究了可被内源性H2S触发的Au@Cu2O对结肠癌进行诊断和治疗的性能。与Cu2O相比,Au@Cu2O在近红外区域的吸收能力明显增强,其光热转换效率也提高了1.2倍。实验结果表明,Au@Cu2O在体内也具有良好的光声成像和光热性能,因此在非常低的注射剂量下也能有效治疗结肠癌。
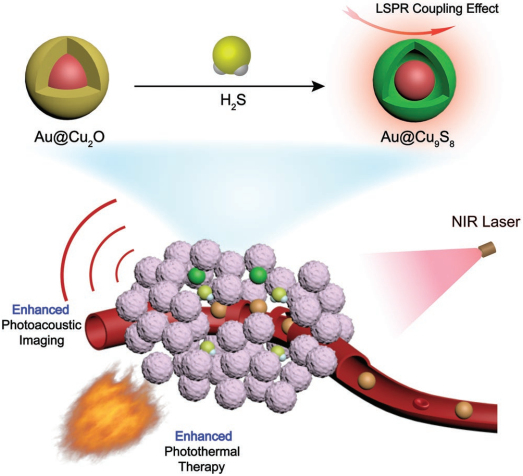
Cheng Tao, Qiwei Tian, Shiping Yang. et al. Surface Plasmon Resonance–Enhanced Photoacoustic Imaging and Photothermal Therapy of Endogenous H2S-Triggered Au@Cu2O. Small. 2019
DOI: 10.1002/smll.201903473
https://onlinelibrary.wiley.com/doi/10.1002/smll.201903473
16. AM综述:与神经系统相连接的电子学设备
开发能够与神经系统相连接的电子学设备是目前基础科学和临床医学领域中的一个重要研究方向。这种含有阵列电极的设备既可用于研究正在培养生长的细胞,也可通过植入受损或功能失调的组织以使其恢复正常功能。并且一旦被植入,这些设备中所含有的细胞就会融入组织,成为电极-组织界面的中介。
剑桥大学Damiano G. Barone教授团队根据不同的宿主位置(中枢神经系统、中枢神经系统或特殊感官)对目前关于生物混合设备的研究概况进行了综述,介绍了其发展的历史背景;最后也总结了该技术所面临的主要挑战和未来的研究方向。

Amy E. Rochford, Damiano G. Barone. et al. When Bio Meets Technology: Biohybrid Neural Interfaces. Advanced Materials. 2019
DOI: 10.1002/adma.201903182
https://onlinelibrary.wiley.com/doi/10.1002/adma.201903182
17. Chem. Soc. Rev.:纳米颗粒在疾病中与血管系统相互作用
无机纳米粒子(NPs)在生物医学中被广泛用于成像和药物递送系统。在癌症治疗中,纳米药物可依赖于EPR效应通过内皮细胞递送抗癌药物。然而,这种响应往往依赖于肿瘤微环境,并且不是在所有类型的肿瘤中都能持续观察的到。与此同时,越来越多的人也开始利用无机NPs来诱导内皮细胞发生渗漏,进而为控制药物在内皮细胞内的递送提供了可能。
这种主动靶向的方法与EPR效应十分类似,而它的药物传递应用并不局限与癌症治疗,而已经扩展到对其他血管相关疾病的治疗中。新加坡国立大学David Tai Leong教授团队总结概述了对EPR效应的最新发现,并对其在抗癌药物递送系统中的应用局限性进行了评估;同时也对NPs诱导的内皮细胞泄漏(NanoEL)现象进行了介绍,讨论了NanoEL效应的主要机制特征和其在治疗血管相关疾病以及癌症中的适用性。
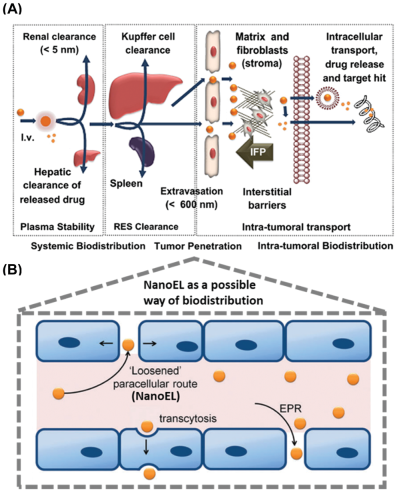
Jie Kai Tee, David Tai Leong. et al. Nanoparticles’ interactions with vasculature in diseases. Chemical Society Reviews. 2019
DOI: 10.1039/C9CS00309F
https://pubs.rsc.org/en/content/articlelanding/2019/cs/c9cs00309f#!divAbstract
18. ACS Nano:线粒体内两亲性肽的异质组装用于超分子癌症治疗
韩国科学技术院Sehoon Kim、蔚山国家科学技术研究院Sang Kyu Kwak和Ja-Hyoung Ryu合作,利用癌细胞线粒体内的两亲性多肽的异质组装,构建了具有精确的形态学和生物学特性的纳米结构。
实验利用具有线粒体靶向特性的Mito-FF和Mito-FF在细胞内进行自组装,发现二者的协同作用可以在体内外引起癌细胞线粒体的破坏。这以工作充分证明了手性控制对生物系统内肽的自组装会有显著影响,从而也为设计肽生物材料提供了一个新的有效策略。
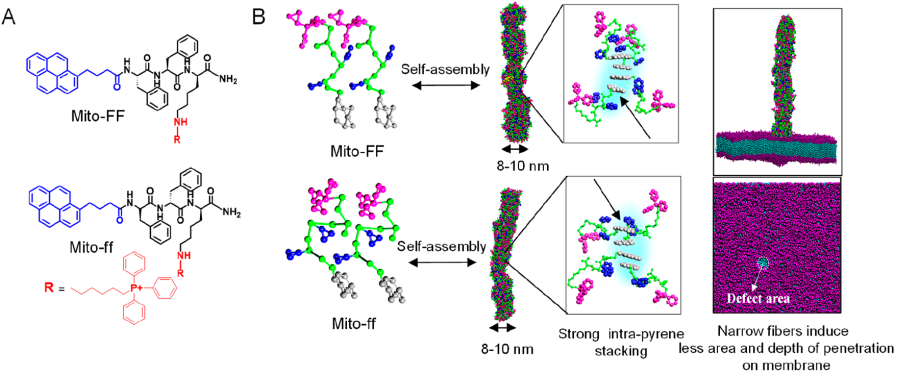
M. T. Jeena, Sang Kyu Kwak, Sehoon Kim, Ja-Hyoung Ryu. et al. Heterochiral Assembly of Amphiphilic Peptides Inside the Mitochondria for Supramolecular Cancer Therapeutics. ACS Nano. 2019
DOI: 10.1021/acsnano.9b02522
https://pubs.acs.org/doi/10.1021/acsnano.9b02522
19. AM:对脑内和肿瘤内血管进行NIR-II光激发的双光子成像
对脑内或肿瘤内血管的形态和动力学进行具有高穿透深度、高信号背景比(SBR)肿瘤活体荧光成像,对于研究血管相关疾病和癌症来说具有重要的意义。南京工业大学刘杰博士和新加坡国立大学刘斌教授合作设计了一种高亮度荧光团(BTPETQ),它具有长波长吸收和聚集诱导近红外(NIR)发射(最大波长为700 nm)的特性,可以用于在NIR- II光(1200 nm)激发下对小鼠的大脑和肿瘤血管进行活体双光子荧光(2PF)成像。
实验通过纳米沉淀法制备的BTPETQ在水介质中粒径均匀,量子产率高达19 1%。研究进一步利用BTPETQ对小鼠大脑血管结构进行2PF成像,可以得到一个为924 µm的三维血管网络。此外,由于肿瘤部位血管具有渗漏的结构特点,BTPETQ可在其中实现增强的2PF,这也有助于实现对正常血管和深部肿瘤组织血管进行区分。
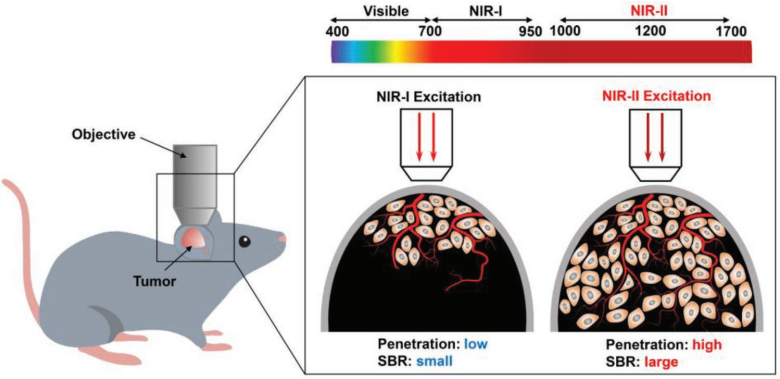
Shaowei Wang, Jie Liu, Bin Liu. et al. NIR-II-Excited Intravital Two-Photon Microscopy Distinguishes Deep Cerebral and Tumor Vasculatures with an Ultrabright NIR-I AIE Luminogen. Advanced Materials. 2019
DOI: 10.1002/adma.201904447
https://onlinelibrary.wiley.com/doi/10.1002/adma.201904447
20. Adv. Sci.:非平面芳香烃诱导的DNA损伤用于选择性杀伤癌细胞
化疗药物可以通过抑制癌细胞的DNA合成来阻止肿瘤的生长。近年来的研究发现,许多平面多环芳烃(PAHs)衍生物可以通过与DNA交联而产生抗癌活性。然而,由于这些多环芳烃对大多数肿瘤的治疗效率和选择性都较低,其实际应用也受到了很大的限制。上海交通大学邱惠斌教授和刘培峰教授合作报道了一种具有抗癌特性的非平面多环芳烃[4] helicenium,与正常细胞相比,它对肝癌、肺癌和白血病细胞等都具有高度选择性的细胞毒性。
因此,[4] helicenium对荷瘤小鼠的肿瘤生长有明显的抑制作用,而对正常小鼠则无明显副作用。实验结果表明,[4] helicenium对肿瘤细胞DNA的损伤程度会高于正常细胞,导致肿瘤细胞周期阻滞和凋亡增加。这一研究充分揭示了多环芳烃在选择性杀伤肿瘤细胞中的作用和分子机制,从而为肿瘤的精准治疗提供了有效的新策略。
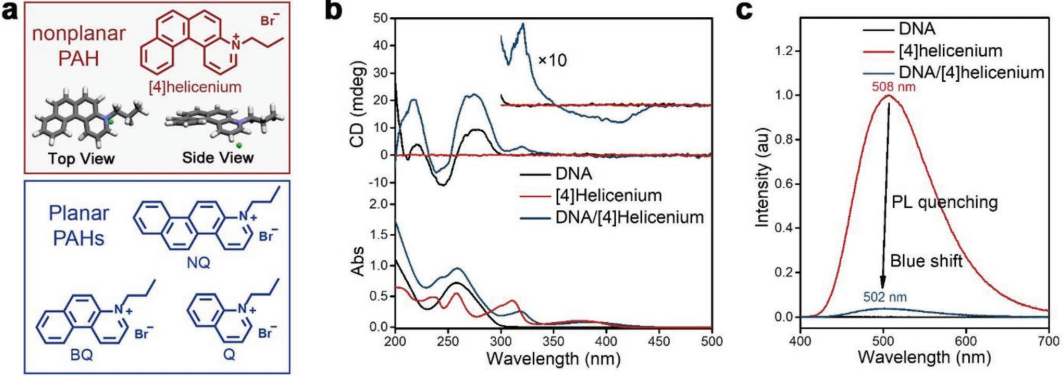
Yan Zhou, Huibin Qiu, Peifeng Liu. et al. Selective Killing of Cancer Cells by Nonplanar Aromatic Hydrocarbon-Induced DNA Damage. Advanced Science. 2019
DOI: 10.1002/advs.201901341
https://onlinelibrary.wiley.com/doi/10.1002/advs.201901341
21. Small:靶向递送isoDGR标记的纳米金以实现免疫协同治疗
白细胞介素-12 (IL12)是一种具有强大免疫治疗抗癌活性的细胞因子,但是其临床应用也受到较大的全身毒性的限制。IRCCS圣拉斐尔科学研究所Angelo Corti 教授和Flavio Curnis博士合作,利用环化肽CGisoDGRG (Iso1)和小鼠IL12对金纳米球进行功能化,所得到的Iso1 / Au / IL12是单分散且稳定,且具有识别αvβ3和IL12受体的能力。
研究结果表明,注射低剂量的Iso1/Au/IL12(相当于18-75 pg的IL12)可以在纤维肉瘤和乳腺癌小鼠模型中诱导产生显著的抗肿瘤作用,并且不会引发毒性。而注射同等剂量的Au/IL12(缺乏Iso1的纳米药物)则不能抑制肿瘤的生长,游离的IL12也只有在达到15000 pg时才能达到类似的效果。并且,Iso1/Au/IL12可以显著增强天然免疫细胞(如NK、iNKT细胞、单核细胞、中性粒细胞)对肿瘤的影响。这一研究表明,将IL12与isoDGR标记的纳米金进行偶联是提高IL12治疗效果和维持过继性细胞免疫治疗的一种有效策略。
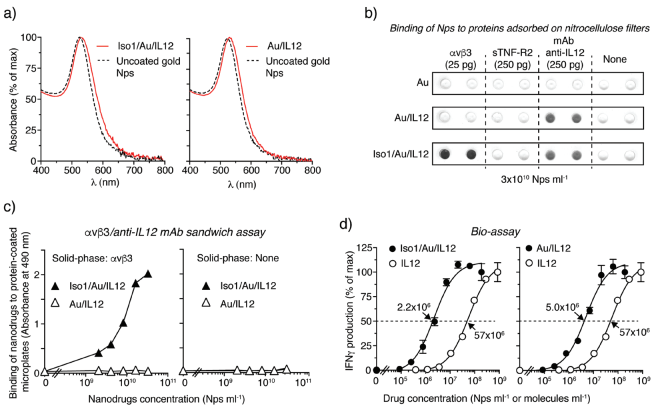
Anna Maria Gasparri, Angelo Corti, Flavio Curnis. et al. Boosting Interleukin-12 Antitumor Activity and Synergism with Immunotherapy by Targeted Delivery with isoDGR-Tagged Nanogold. Small. 2019
DOI: 10.1002/smll.201903462
https://onlinelibrary.wiley.com/doi/full/10.1002/smll.201903462











