
第一作者:Xiao Han、Shufang Shen
通讯作者:汪超、刘庄、顾臻
通讯单位:苏州大学
研究亮点:
1. 发展了一种来源安全的纳米红细胞体,通过膜融合方式载入抗原,无需化学反应方式。
2. 利用衰老或受损的RBC是巨噬细胞和脾脏树突状细胞的清除目标的特点,将纳米红细胞体靶向至体内这两种主要的抗原呈递细胞。
3. 实现了个性化治疗
免疫检查点阻断治疗
免疫检查点阻断(ICB)治疗启动了患者的免疫系统,导致各种类型的肿瘤消退。但是,在一些恶性肿瘤中,免疫应答率仍然很低,并且在ICB治疗后可能发生免疫相关的不良事件,这表明该方法需要改进以在降低毒性的同时使活性最大化。
通过ICB与其他治疗方法的结合已被证明可以提高应答率。其中,一些临床试验已经证实,癌症疫苗可以在癌症患者中引发免疫反应,但是客观临床反应的实现仍然具有挑战性。
可能的原因包括肿瘤微环境的免疫抑制特性(如肿瘤细胞的程序性死亡配体1(PD-L1)的高表达)。另外,在抗原呈递细胞(APC)上的PD-L1表达不能诱导T细胞增殖而能够诱导调节性T细胞。因此,抗PD-L1(aPDL1)与癌症疫苗的组合可能是有益的。
另外,肿瘤抗原向专职性APCs在体内的低效率递送会导致癌症疫苗的效力降低。在过去的几十年中,已经在动物模型中报道了各种抗原递送系统。与游离抗原相比,微纳米制剂和大尺寸的生物材料作为有效的抗原递送工具和作为改善免疫反应的佐剂可以产生强大的抗肿瘤免疫反应。
但是,其中许多是合成材料,需要化学结合。由于临床实践中与生理相互作用和新陈代谢,此类递送系统的安全性仍需考虑。
成果简介
因此,苏州大学汪超教授、刘庄教授、加州大学洛杉矶分校顾臻教授等人报道了一种基于红细胞膜和aPDL1阻断剂的组合癌症疫苗,利用受损的RBC将肿瘤相关抗原(TAAs)输送至关键的次级淋巴器官的APCs,可有效增强癌症免疫疗法。
研究人员通过将肿瘤细胞膜相关抗原与纳米红细胞融合在一起,将肿瘤抗原加载到纳米红细胞上。这种载有肿瘤抗原的纳米红细胞体(nano-Ag@erythrosome)在体内引起抗原反应,并与抗程序性死亡配体1(PD-L1)阻断相结合,抑制了B16F10和4T1肿瘤模型中的肿瘤生长。在生成的一个肿瘤模型中显示通过融合红细胞和手术切除的肿瘤可以实现“个性化nano-Ag@erythrosome”,从而有效地减少了手术后的肿瘤复发和转移。
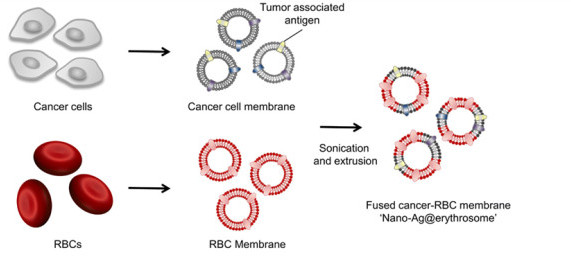
图1. Nano-Ag@erythrosome的制备示意图
要点1:Nano-Ag@erythrosome的制备与DC细胞的摄取
研究人员通过超声和物理挤压方法获得了红细胞膜和肿瘤膜融合的nano-Ag@erythrosome,SDS-PAGE凝胶电泳和Western blot实验都表明了抗原成功地载到了nano-Ag@erythrosome,即两种膜融合在一起。通过与树突状细胞(DC)共孵育,激光共聚焦和流式结果证明nano-Ag@erythrosome能被DC细胞摄取并且上调了CD80和CD86的表达。
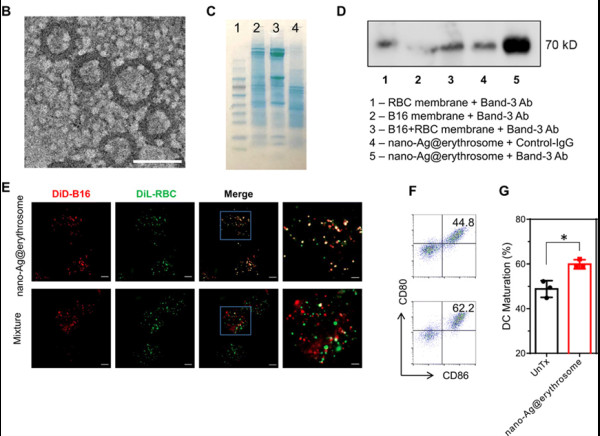
图2. Nano-Ag@erythrosome的表征
要点2:Nano-Ag@erythrosome激活各种免疫细胞
为了评估nano-Ag@erythrosome对APCs体内靶向的作用,研究人员根据蛋白质重量调节RBC膜与肿瘤细胞膜(R:T)的比例。实验表明R:T=20:1时,nano-Ag@erythrosome可以很好的靶向到脾。通过检测注射nano-Ag@erythrosome后体内的免疫细胞的各种因子的表达情况。这些结果表明nano-Ag@erythrosome有效激活了体内各种免疫细胞。
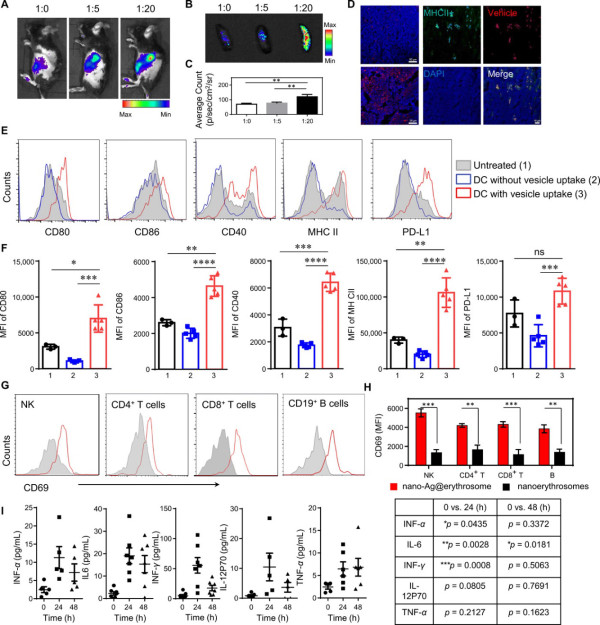
图3. Nano-Ag@erythrosome靶向脾APC并诱导免疫细胞活化
要点3. Nano-Ag@erythrosome联合PD-L1阻断剂的治疗功效
紧接着,研究人员测试了nano-Ag@erythrosome在荷瘤C57BL/6小鼠中的治疗效果。在B16F10-Luc肿瘤模型中,小鼠接受了三剂含或不含aPDL1的nano-Ag@erythrosome。尽管肿瘤生长不受单独的nano-Ag@erythrosome的影响,但与aPDL1的组合是有效的。
通过检测肿瘤中环境,发现肿瘤浸润性淋巴细胞增多进一步导致IFN-γ上升,并会上调PD-L1,然而通过检测非造血细胞(CD45−细胞)上的PD-L1表达,发现与aPDL1治疗联合使用时,肿瘤在CD45−细胞上具有较低的PD-L1表达,这表明在肿瘤微环境中对PD-L1介导的T细胞衰竭具有抑制作用。总体而言,这些结果表明,通过aPDL1处理可增大由nano-Ag@erythrosome的抗癌免疫应答。
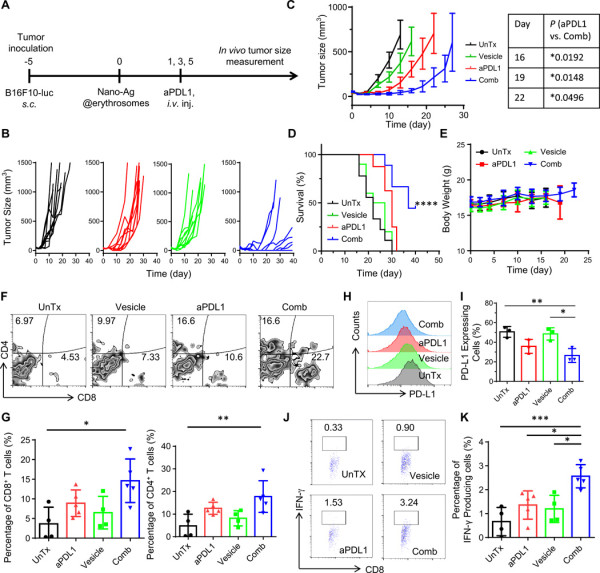
图4.用于体内抑制B16F10-Luc黑色素瘤生长的联合免疫疗法
要点4:个性化治疗
在癌症患者中,个性化的癌症疫苗可能至关重要,因为每个患者的基因突变都会导致表达独特的肿瘤新抗原的产生。因此,研究人员还实施了一个模型模型,以评估所开发的方法在切除原发肿瘤后是否能够抑制肿瘤的复发和转移扩散。
通过手术切除肿瘤后,获得单细胞悬液,并从相同的荷瘤小鼠中收集RBC,以产生自体nano-Ag@erythrosome。结果表明,nano-Ag@erythrosome联合aPDL1治疗组控制了继发性肿瘤的生长并在手术后延长了生存期,且与对照组相比没有明显的副作用。
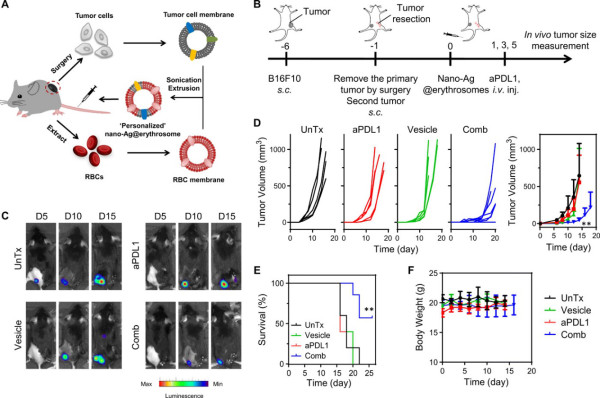
图5.自组装纳米结构抑制肿瘤生长研究
小结
综上所述,这项工作开发了一种使用纳米红细胞体将TAAs递送至脾脏DC的新方法,且扩展该方法以开发个性化的肿瘤疫苗。此外,这种基于红细胞体的技术可以与其他具有特定物质的膜融合在一起,以治疗不同的疾病。
参考文献:
Han, X.; Shen, S.; Fan, Q.; Chen, G.; Archibong, E.; Dotti, G.; Liu, Z.; Gu, Z.; Wang, C., Red blood cell–derived nanoerythrosome for antigen delivery with enhanced cancer immunotherapy. Science Advances2019, 5 (10), eaaw6870.
https://advances.sciencemag.org/content/5/10/eaaw6870











