膜载体源于体内,具有许多天然性质,利用其“伪装”纳米药物载体,不仅能逃脱免疫系统检查,延长血液循环时间,还能提高其生物相容性,降低在内脏器官中的富集和毒副作用。
以下对近期膜载体相关的研究进行分类归纳,以供大家学习交流。
红细胞膜载体
AM:人造的自然杀伤细胞用于特异性肿瘤抑制和巨噬细胞再教育
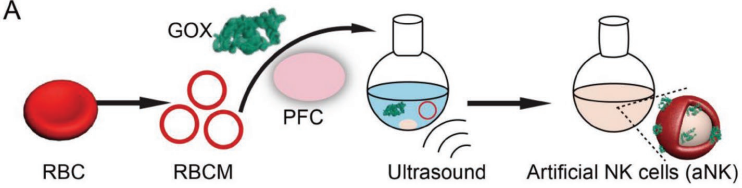
自然杀伤(NK)细胞不仅能识别和消除异常细胞,还能对免疫细胞进行募集和再教育以保护宿主。然而,NK细胞的功能在免疫抑制的肿瘤微环境(TME)中往往会受到限制。武汉大学张先正教授团队设计了一种人造的NK细胞(aNK),TME对aNK的限制作用很低,且它可以对巨噬细胞进行再教育以抑制肿瘤。
实验利用血红细胞膜(RBCM)去包裹全氟正己烷(PFC)和葡萄糖氧化酶(GOX)构建了aNK。Ank可通过消耗葡萄糖和生成过氧化氢(H2O2)来直接杀死肿瘤细胞。并且生成的H2O2也可作为细胞因子和趋化因子来募集免疫细胞,并对存活的巨噬细胞进行再教育,使其攻击肿瘤细胞。此外,载氧的PFC可以增强GOX的催化反应,改善乏氧的TME。体内外实验结果表明,aNK具有很好的肿瘤抑制和免疫激活作用。
Mei-ZhenZou, Xian-Zheng Zhang. et al. Artifcial Natural Killer Cells for Specific TumorInhibition and Renegade Macrophage Re-Education. AdvancedMaterials. 2019
DOI:10.1002/adma.201904495
https://onlinelibrary.wiley.com/doi/10.1002/adma.201904495
AM:胞内/胞外乳酸耗竭协同代谢治疗与肿瘤免疫治疗
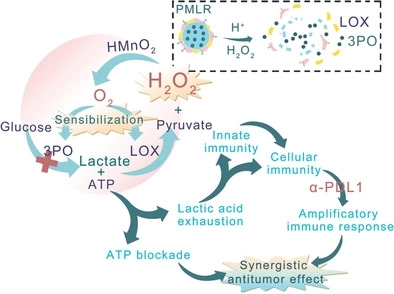
调节肿瘤微环境(TME)已成为提高抗肿瘤治疗水平的一种新型策略。在此,武汉大学张先正研究团队构建了一个嵌入乳酸氧化酶(LOX)和糖酵解抑制剂(PMLR)的红细胞膜(mRBC) 伪装的中空MnO2(HMnO2)催化纳米系统,用于细胞内/细胞外乳酸耗竭以及协同代谢治疗和肿瘤免疫治疗。受益于mRBC的长循环特性,此纳米系统可以通过增强的通透性和滞留(EPR)效应在肿瘤部位逐渐积累。胞外纳米系统通过LOX催化氧化反应,消耗TME中的乳酸。
同时,胞内纳米系统释放糖酵解抑制剂,切断乳酸来源,并通过阻断三磷酸腺苷(ATP)的供应实现抗肿瘤代谢治疗。在PMLR纳米系统催化内源性H2O2分解过程中产生的O2对胞内胞外过程都有敏化作用。研究表明,PMLR纳米系统能够不断去除乳酸,从而产生具有免疫活性的TME。此外,这种TME调节策略可有效提高抗PDL1治疗的抗肿瘤效果,而无需使用任何免疫激动剂来避免自身免疫。
FanGao, Ying Tang, Wen-Long Liu, et al. Intra/Extracellular Lactic Acid Exhaustionfor Synergistic Metabolic Therapy and Immunotherapy of Tumors. Adv. Mater.,2019.
https://doi.org/10.1002/adma.201904639
ACS nano: 基于纳米马达的胞内氧气运输的主动传输系统
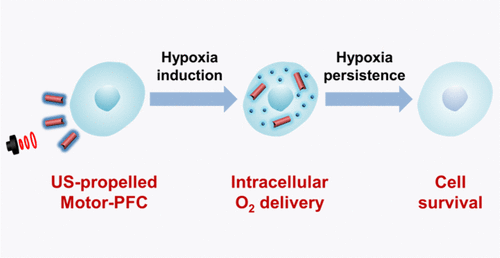
气体分子的主动转运对维持生物体的生理功能至关重要。氧作为最基本的气体分子,在维持细胞新陈代谢和活性中起着重要的作用。基于此,加州大学圣地亚哥分校Joseph Wang和张良方研究团队报告了一种基于纳米马达的传递系统,该系统结合了声动力金纳米线(Au NW)的快速推进和红细胞膜包裹的全氟碳纳米乳(RBC-PFC)的高携氧能力,用于细胞内氧气的主动运输。主要在超声场下研究了载有RBC-PFC的AuNW纳米马达(Motor-PFC)的氧传输能力和动力学特征。
具体而言,Motor-PFC在声场下的快速运动加速了J774巨噬细胞的胞内氧气运输。进入细胞后,Motor-PFC中负载的氧气会持续释放,可在缺氧条件下维持细胞活性。与游离RBC-PFC或被动Motor-PFC相比,声动力Motor-PFC可在72h内显著提高细胞活性(84.4%)(游离RBC-PFC为44.4%,被动Motor-PFC为32.7%)。实验结果表明,Motor-PFC可作为高效的运输载体用于胞内氧气的主动运输。尽管此项研究中仅使用氧气作为模型气体分子,但Motor-PFC平台可以轻易扩展到将其他气体分子主动输送到各种靶细胞。
Fangyu Zhang, Liangfang Zhang, Joseph Wang, et al. A Nanomotor-Based Active Delivery System for Intracellular Oxygen Transport. ACS nano, 2019.
https://doi.org/10.1021/acsnano.9b06127
T细胞膜载体
AM:模拟T细胞的纳米颗粒用于治疗HIV的传染
为了改善对人类免疫缺陷病毒(HIV)的治疗和预防,开发有效的针对广谱病毒感染的治疗策略是非常重要的。在最近的细胞膜包覆技术的启发下,美国加州大学圣地亚哥分校Stephen A. Spector联合张良方教授团队将CD4+ T细胞膜被收集并涂在聚合核表面。由此产生的T细胞膜涂层纳米颗粒(TNPs)具有对HIV结合至关重要的T细胞表面抗原。TNPs作为病毒攻击的诱饵,可以将病毒从它们预定的宿主目标中转移出来,从而中和HIV病毒。这个诱骗策略有助于克服HIV的遗传多样性。
研究表明,TNPs会有选择性地与gp120结合,这是一种HIV病毒的重要包膜糖蛋白。因此TNPs可以有效地中和了单核血细胞和人类单核细胞衍生的巨噬细胞的病毒感染。这一研究证明利用天然T细胞的功能的TNPs作为一种新的治疗药物来对抗HIV感染具有巨大的潜力。
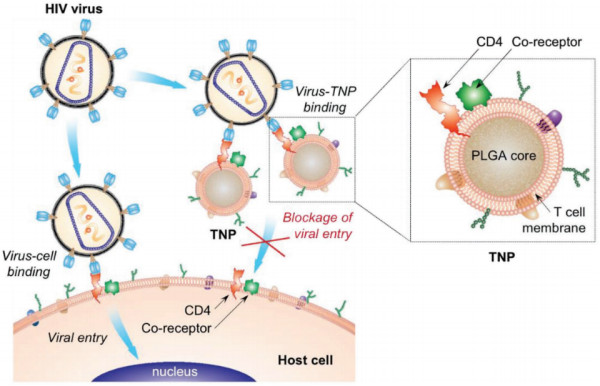
Wei X,Zhang G, et al. T-Cell-Mimicking Nanoparticles Can Neutralize HIV Infectivity[J]. Advanced Materials, 2018.
https://doi.org/10.1002/adma.201802233
Adv. Sci.:T细胞膜纳米粒子利用生物正交靶向和免疫识别技术增强光热治疗
由于T细胞表面存在特异性免疫识别受体,它们的膜有望成为一种高效的纳米载体来将药物递送到肿瘤病灶。然而,由于肿瘤内部的异质性,这种单一的靶向策略往往效率不足。而叠氮(N3)或双环[6.1.0]壬炔(BCN)改性的非天然糖可以作为人工受体成功地结合到各种肿瘤细胞的表面糖基中,这也有望克服单一靶向策略的不足。
中科院深圳先进技术研究院郑明彬博士、蔡林涛教授和广东医科大学李宝红教授团队合作构建了N3标记的T细胞膜(N3-TINPs)包裹的吲哚菁绿纳米粒(INPs),它可以通过免疫识别和生物正交化学作用来特异性地靶向肿瘤上的天然抗原和BCN人工受体。结果表明,注射了N3-TINPs的小鼠的肿瘤的荧光强度是注射单纯TINPs的小鼠的1.5倍。并且肿瘤内积累的N3-TINPs也可显著提高光热治疗效果,同时有效降低不良的副作用反应。
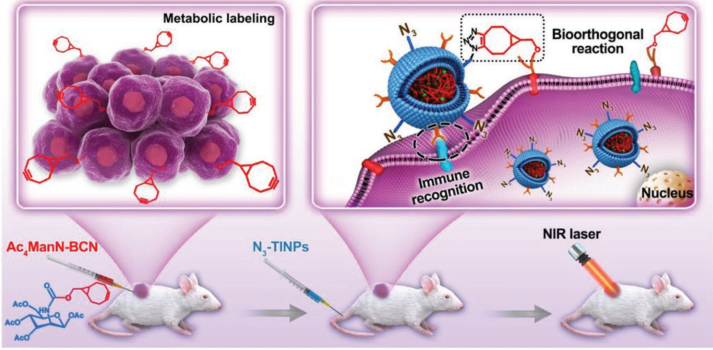
YutongHan, Mingbin Zheng, Baohong Li, Lintao Cai. et al. T Cell Membrane MimickingNanoparticles with Bioorthogonal Targeting and Immune Recognition for EnhancedPhotothermal Therapy. Advanced Science. 2019
https://doi.org/10.1002/advs.201900251
癌细胞膜同源靶向
AFM:负载异烟肼的WSSe/MnO2纳米复合材料用于肿瘤的协同治疗
北京科技大学董海峰教授团队利用Mn2+可催化异烟肼(INH)产生羟基自由基(•OH)和WSSe纳米片的光热效应,制备了一种WSSe/MnO2-INH纳米复合材料,并将其用于协同抗癌治疗。实验结果表明,WSSe/MnO2纳米复合材料具有良好的光热转换效率,并且可以通过非芬顿反应的机理诱导产生•OH。
实验利用可靶向线粒体的三苯基溴化膦(TPP)分子对其进行修饰,并使用癌细胞膜对其进行伪装得到具有靶向癌细胞线粒体的WSSe/MnO2-INH-TPP@CM。并且该纳米复合材料也具有对肿瘤进行CT成像和磁共振成像的能力。研究表明,WSSe/MnO2- INH-TPP@CM在体内外均表现出良好的抗癌治疗效果,因此这一工作也为基于ROS的癌症联合治疗提供了新的策略。
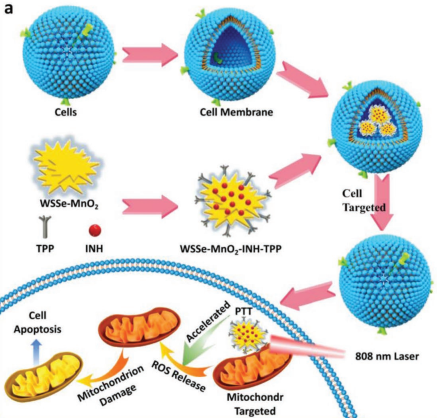
YaruCheng, Haifeng Dong. et al. Non-Fenton-Type Hydroxyl Radical Generation and Photothermal Effect by Mitochondria-Targeted WSSe/MnO2 NanocompositeLoaded with Isoniazid for Synergistic Anticancer Treatment. Advanced Functional Materials. 2019
DOI:10.1002/adfm.201903850
https://onlinelibrary.wiley.com/doi/10.1002/adfm.201903850
Nano Lett.:嵌入光敏剂的癌细胞膜对免疫调节脂质复合物功能化以抑制肿瘤
脂质体在临床上常被用作癌症治疗的药物载体。然而,包封的抗癌药物往往会发生意外渗漏,且脂质体靶向肿瘤的效率较低,这些都会对健康细胞产生毒副作用,导致肿瘤的治疗和根除失败。首尔国立大学Byung-Soo Kim团队使用了一种被嵌入了光敏剂(KillerRed, KR)的癌细胞膜(CCM)功能化的脂质体复合物,并在其中还加入了一种脂质佐剂以提高抗癌免疫反应。
研究表明,KR蛋白会在CCM上表达且不从脂质复合体中渗漏出去。由于CCM对源癌细胞具有同源亲和性,该脂质复合物在体内的靶向性比对照组高3.3倍。光动力治疗结果表明,该脂质复合物可以提高产生细胞毒性活性氧来有效地诱导肿瘤免疫反应,进而抑制荷瘤小鼠的原发肿瘤生长和肺转移。
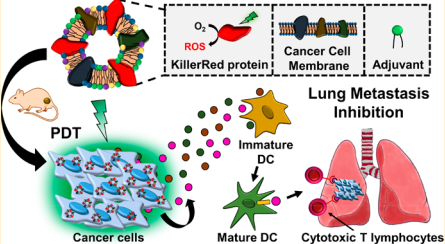
Han Young Kim, Byung-Soo Kim. et al. Immunomodulatory Lipocomplex Functionalized with Photosensitizer-Embedded Cancer Cell Membrane Inhibits Tumor Growth and Metastasis. Nano Letters. 2019
DOI: 10.1021/acs.nanolett.9b01571
https://pubs.acs.org/doi/10.1021/acs.nanolett.9b01571
Adv. Sci.:Janus纳米子弹用于增强协同的抗肿瘤转移免疫疗法
光动力疗法(PDT)可以有效治疗原发性肿瘤,但对远处的转移瘤往往无效。大连理工大学孙文博士和中科院苏州生物医学工程技术研究所董文飞研究员合作,利用免疫原性纳米颗粒介导的联合PDT和磁热治疗来协同增强抗肿瘤转移的免疫疗法。实验利用肿瘤细胞膜对该Janus纳米子弹进行包裹得到M-MONs@Ce6,它具有良好的肿瘤靶向效果和较长的血液循环时间。
结果表明,PDT和磁热疗法相结合后具有很强的协同抗癌活性,并会引发免疫原性细胞死亡,从而产生肿瘤特异性免疫反应。在进一步结合抗CTLA-4抗体后,该仿生纳米颗粒可显著清除原发和转移性肿瘤。
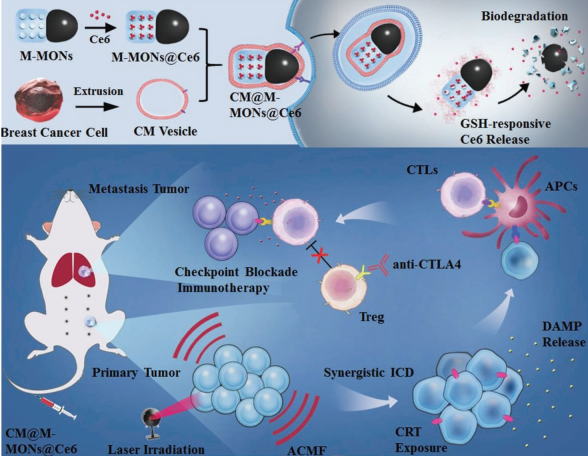
ZhengWang, Dan Shao, Wen Sun, Wen-Fei Dong. et al. Janus Nanobullets Combine Photodynamic Therapy and Magnetic Hyperthermia to Potentiate Synergetic Anti-Metastatic Immunotherapy. Advanced Science. 2019
https://onlinelibrary.wiley.com/doi/10.1002/advs.201901690
AFM:肿瘤细胞膜包裹的纳米粒子用于异性移植模型中的个体化治疗
细胞膜包覆纳米技术赋予了纳米粒子独特的性质,在癌症诊断和治疗中具有巨大的转化潜力。然而,这些细胞膜包裹纳米颗粒的制备和评估是基于细胞系和细胞系异种移植小鼠模型而建立的。在临床前环境中,需细胞膜伪装纳米材料的可行性进行测试。美国国立卫生研究院陈小元教授课题组将头颈部鳞状细胞癌(HNSCC)患者源性肿瘤细胞(PDTC)膜包裹在明胶纳米颗粒(GNPs)上,得到的PDTC@GNPs在患者源性异种移植(PDX)模型中显示出对同型肿瘤细胞和组织的高效靶向性。
当PDTC@GNPs供体细胞膜与宿主细胞膜相匹配时,可观察到显著的靶向性。相反,供体和宿主之间的不匹配会导致靶向性减弱。此外,研究表明,在皮下模型中,细胞膜的自体分离和给药以及负载抗癌药物顺铂(Pt)的PDTC@GNPs可分别导致肿瘤几乎完全消融,且在术后模型中能有效抑制肿瘤复发。此项工作加强了这些仿生纳米颗粒在临床应用中的转化,并为个性化癌症治疗提供了一种简单、安全、高效的策略。
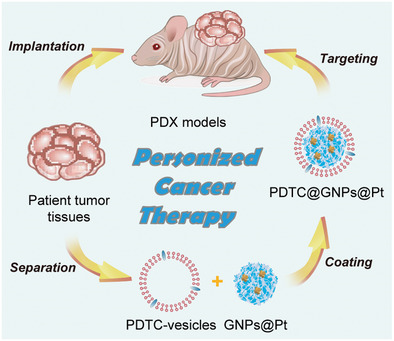
Haihua Xiao, Zhi-Jun Sun, Xiaoyuan Chen, et al. Cancer Cell Membrane‐Coated Nanoparticles for Personalized Therapy in Patient‐Derived Xenograft Models. Adv. Funct. Mater., 2019.
https://doi.org/10.1002/adfm.201905671
Nano Lett:卵黄-壳结构的癌细胞膜包裹纳米颗粒增强了癌症的化学疗法
尽管抗肿瘤药物递送迅速进步,但是细胞内转运不足和亚细胞药物积聚仍是要解决的问题。癌细胞膜(CCM)伪装的纳米颗粒(NPs)由于其免疫逃逸和同型结合能力而在肿瘤治疗中非常具有的潜力。然而,由于无效的肿瘤渗透和细胞内运输,它们的功效仍然受到限制。于此,中国科学院上海药物研究所甘勇研究员课题组开发了一种蛋黄壳结构的NP,以介孔二氧化硅纳米粒子(MSN)支撑的聚乙二醇化脂质体为蛋黄和并用CCM包裹(CCM@LM),用于化学疗法和肿瘤同源靶向。
卵黄-壳结构赋予CCM@LM具有中等的刚性,这可能有助于渗透过程中频繁地转变成椭圆形,从而促进体外多细胞球体的渗透(与膜囊泡的渗透相比增加了23.3倍)。CCM@LM还表现出模仿包膜病毒入侵特征的细胞入侵特征。CCM@LM通过膜融合直接内在化,随后聚乙二醇化蛋黄(LM)释放到细胞质中,表明内在化途径的执行类似于包膜病毒。进入的PEG化LM进一步在整个细胞骨架细丝网络中进行有效运输,导致增强的核周聚集。最终,将小剂量阿霉素和聚(ADP-核糖)聚合酶抑制剂盐酸甲福帕尼共包封的CCM@LM比一线化疗药物多西尔明显更强的抗肿瘤作用。我们的发现突出表明,可促进的肿瘤渗透和强大的细胞内运输的NPs在癌症化疗具有非常大的前景。
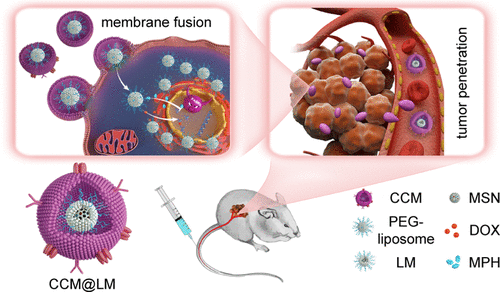
Nie, D.; Dai, Z.; Li, J.; Yang, Y.; Xi, Z.; Wang, J.; Zhang, W.; Qian, K.; Guo, S.; Zhu, C.; Wang, R.; Li, Y.; Yu, M.; Zhang, X.; Shi, X.; Gan, Y., Cancer-Cell-Membrane-Coated Nanoparticles with a Yolk–Shell Structure Augment Cancer Chemotherapy. Nano Letters 2019.
https://doi.org/10.1021/acs.nanolett.9b03817
外泌体递送策略
Nature. Catal.:装载有超薄钯纳米片的癌症衍生外泌体用于靶向生物正交催化
生物正交化学启发了科学家们发展通过非天然方式体内合成生物活性剂的新策略。其中,Pd催化剂通过在生命系统中产生异生素和解笼菌生物分子,在生长正交催化领域中发挥了突出作用。然而,选择性地将催化剂递送至特定类型的细胞落后于催化剂的开发。
近日,萨拉戈萨大学Jesús Santamaría,爱丁堡大学Asier Unciti-Broceta等开发了一种人工生物装置,其含有负载了Pd纳米片催化剂的癌症衍生的外泌体。该杂化系统可在体外和细胞内介导Pd-触发的脱烷基化反应,并显示其祖细胞的优先向性。此外,使用特洛伊木糖外泌体将非生物催化剂输送到指定的癌细胞中,为新的靶向治疗方式创造了机会。
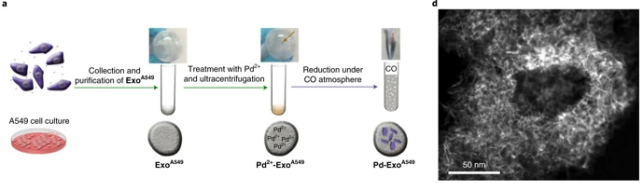
María Sancho-Albero, et al. Cancer-derived exosomes loadedwith ultrathin palladium nanosheets for targeted bioorthogonal catalysis. Nat.Catal., 2019
https://www.nature.com/articles/s41929-019-0333-4
Nature Commun.:基于肿瘤外泌体的纳米粒子用于递送化疗药物
在不破坏蛋白质完整性的情况下开发仿生纳米粒子仍然是癌症化疗的一大挑战。华中科技大学甘璐教授、杨祥良教授和赫尔辛基大学Hélder A. Santos合作开发了一种具有良好生物相容性的、基于肿瘤细胞外泌体的仿生多孔硅纳米颗粒(PSiNPs),并将其作为靶向肿瘤的化疗药物递送载体。
这种外泌体包裹的负载有阿霉素的PSiNPs (DOX@E-PSiNPs)在被静脉给药后可有效在肿瘤富集并深入渗透肿瘤内部。并且该DOX@E-PSiNPs可以被癌细胞和癌症干细胞(CSCs)有效地摄取并具有显著地细胞毒性。体内实验结果表明,DOX@E-PSiNPs可以在肿瘤处大量积累,因此在皮下、原位和转移性肿瘤模型中表现出很高的抗癌活性。这一研究表明,基于肿瘤外泌体的仿生纳米颗粒可以作为一种高效的肿瘤化疗药物递送载体。
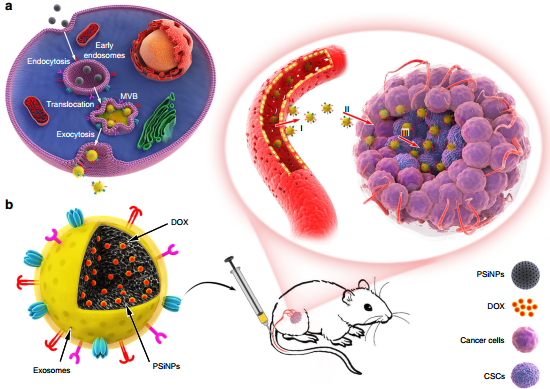
Tuying Yong, Lu Gan, Hélder A. Santos, Xiangliang Yang. et al. Tumor exosome-based nanoparticles are efficient drug carriers for chemotherapy. Nature Communications. 2019
https://www.nature.com/articles/s41467-019-11718-4
Small:功能化DNA对外泌体和囊泡进行编程进而用于肿瘤诊疗
外泌体是一种调节许多生理和病理过程的重要信息载体。中山大学廖玉辉教授和黄曦教授合作,将功能化DNA作为铰链来将量子点(QDs)锚定在外泌体表面,进而设计了一种温和的生物标记策略。研究发现,被QDs标记的外泌体会迅速被肿瘤细胞吞噬,因此它可以作为一种标记肿瘤的特异性试剂。
此外,实验也通过气动脂质体挤出器构建了M1巨噬细胞(M1mv)的人工囊泡,结果发现M1mv可以有效杀死肿瘤细胞,实现理想的生物治疗效果。实验为了增强M1mv的抗肿瘤作用和药物释放的特异性,构建了靶向给药系统并实现了对特异性mRNA响应的药物递送和可视化肿瘤治疗。这一工作开发的策略大大促进了对外泌体和囊泡的标记以及功能化的效率,同时也构建了具有生物治疗和化疗功能的药物递送囊泡,从而为肿瘤的诊疗提供了新的思路。
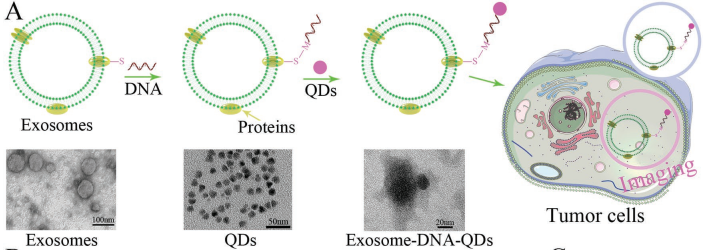
Zhijin Fan, Yuhui Liao, Xi Huang. et al. Functionalized DNA Enables Programming Exosomes/Vesicles for Tumor Imaging and Therapy. Small. 2019
DOI: 10.1002/smll.201903761
https://onlinelibrary.wiley.com/doi/10.1002/smll.201903761
Biomaterials:外泌体-PMA/Au-BSA@Ce6用于荧光成像和靶向光动力治疗
直径约30-150纳米的外泌体(Exos)是治疗药物的理想载体。然而,外泌体的产量不理想、载药过程复杂和载药效率低等问题都严重影响了其在临床中的应用。上海交大张倩博士和崔大祥教授合作采用瞬间电穿孔法制备了尿液Exo-PMA/Au-BSA@Ce6纳米材料。研究表明,该纳米材料可以有效地被癌细胞内化,并能通过其膜结构和抗原以延缓被巨噬细胞内吞,从而延长其血液循环时间。
在633 nm激光照射和酸性条件下,该纳米材料的结构会发生坍塌,大量的PMA/Au-BSA@Ce6纳米颗粒会在癌细胞内释放并产生大量的单线态氧以抑制肿瘤细胞的生长。在MGC-803荷瘤裸鼠的体内实验结果表明,Exo-PMA/Au-BSA@Ce6纳米材料能够有效靶向肿瘤细胞,具有较好的肿瘤穿透性和保留效果。
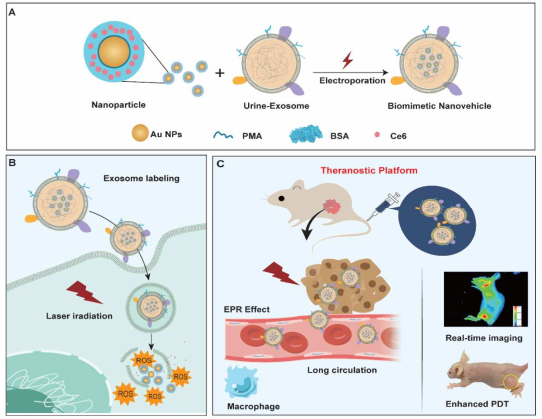
Shaojun Pan, Qian Zhang, Daxiang Cui. et al. Passion fruit-like Exosome-PMA/Au-BSA@Ce6 Nanovehicles for Real-time Fluorescence Imaging and Enhanced Targeted Photodynamic Therapy with Deep penetration and Superior Retention Behavior in Tumor. Biomaterials. 2019
https://www.sciencedirect.com/science/article/pii/S0142961219307057
巨噬细胞膜载体
Nano Lett.:多抗原纳米类毒素用于对抗耐药革兰氏阴性细菌
由耐多药的革兰阴性菌引起的感染已成为全球公共卫生所面临的一项重大威胁。加州大学圣地亚哥分校Ronnie H. Fang博士和张良方教授合作报告了一种基于巨噬细胞膜包裹的纳米颗粒的多抗原纳米类毒素疫苗,该疫苗可诱导对致病性铜绿假单胞菌的强免疫反应。这种仿生纳米疫苗的设计利用了巨噬细胞在清除病原体中的特殊作用以及它们对细菌分泌的各种毒性因子的天然亲和力。
结果表明,巨噬细胞纳米类毒素能有效表达铜绿假单胞菌抗原,其体外和体内的安全性也得到了充分的证实。当通过不同的给药途径给肺炎模型小鼠接种疫苗时,该纳米类毒素能够激发强大的体液免疫反应来对抗炎症感染。这一工作也为利用仿生纳米技术设计安全的、多抗原抗病毒疫苗以及应用这些纳米疫苗预防耐多药革兰氏阴性感染提供了新的策略。
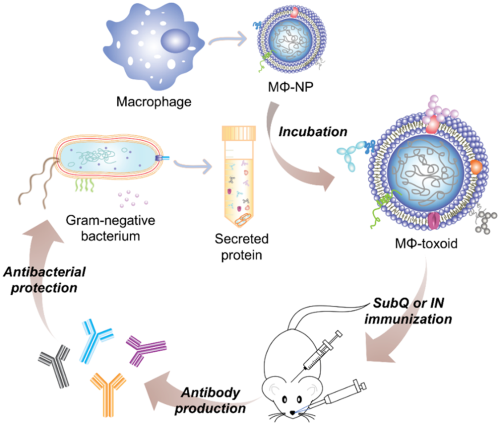
Xiaoli Wei, Danni Ran, Ronnie H. Fang,Liangfang Zhang. et al. Multiantigenic Nanotoxoids for Antivirulence Vaccination against Antibiotic-Resistant Gram-Negative Bacteria. Nano Letters.2019
https://pubs.acs.org/doi/10.1021/acs.nanolett.9b01844











