1. Chem. Rev.:利用分子生物标记物进行疾病检测
开发仿生化学传感器使得使快速、高灵敏度和非侵入性地对健康状况进行诊断成为可能,它可以通过监测一种或多种体液例如汗水、唾液、尿液、精液、乳液、眼泪、粪便、血液、间质液和脑脊液等中的生物标志物来实现这一目标。
西安电子科技大学吴巍炜博士和以色列理工学院Hossam Haick教授合作,对利用分子生物标记物进行疾病检测的相关研究进行了综述,并对用于评价检测生物标记物的新兴化学、传感材料和相关的技术概念以及方法进行了详细介绍;随后对每种方法的优缺点进行了讨论和批评;最后也展望了这一领域的未来发展方向。

Yoav Y. Broza, Weiwei Wu, Hossam Haick. et al. Disease Detection with Molecular Biomarkers: From Chemistry of Body Fluids to Nature-Inspired Chemical Sensors. Chemical Reviews. 2019
DOI: 10.1021/acs.chemrev.9b00437
https://pubs.acs.org/doi/10.1021/acs.chemrev.9b00437
2. Anal. Chem.:氧嵌入的半导体发色团纳米探针用于增强的光声成像和光热治疗
光声成像作为一种非侵入性的生物医学成像技术,在体内成像中具有较高的空间分辨率和较深的组织穿透性等优点。湖南大学宋国胜教授团队制备了一种新型基于氧嵌入发色团的PA造影剂,它在聚乙二醇(PEG)的辅助下可以自组装成纳米颗粒(Nano (O-Nonacene)-PEG)。实验表明,Nano (O-Nonacene)-PEG的光热转换效率是半导体聚合物纳米颗粒(Nano(PCPDTBT)-PEG)的1.5倍,是金纳米棒的2.8倍。因此与被广泛用于PA成像的Nano(PCPDTBT)-PEG和Au纳米棒相比,Nano (O-Nonacene)-PEG具有更高的PA信号强度。
并且由于Nano (O-Nonacene)-PEG具有较高的抗光漂白性能,因此它也具有较高的PA信号稳定性,可用于实现PA的长期成像。实验进一步将磁性Zn0.4Fe2.6O4纳米颗粒掺入到Nano (O-Nonacene)-PEG中,结果证明该材料不仅可以产生磁共振信号,而且其光声性能也有大大增强。而由于该材料可以很好地靶向肿瘤,因此它可以对肿瘤实现增强的光声成像和光热治疗,是一个非常高效的肿瘤诊疗平台。
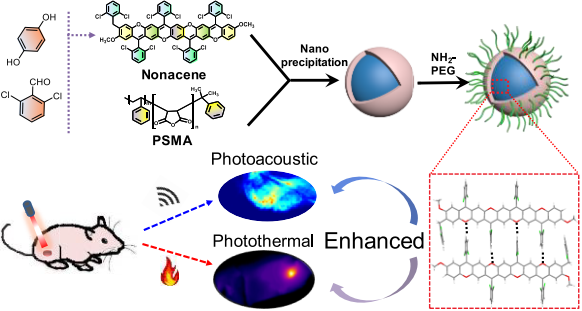
Baoli Yin, Guosheng Song. et al. Oxygen-Embedded Quinoidal Acene Based Semiconducting Chromophore Nanoprobe for Amplified Photoacoustic Imaging and Photothermal Therapy. Analytical Chemistry. 2019
DOI: 10.1021/acs.analchem.9b04429
https://pubs.acs.org/doi/10.1021/acs.analchem.9b04429
3. Theranostics:靶向整合素αvβ3的放射性核素-免疫检查点封锁联合肿瘤治疗
放疗联合免疫治疗在临床研究中表现出良好的效果。其中,放射性核素的靶向治疗(TRT)是放疗的一个重要分支。研究表明,TRT是治疗转移性疾病的一种很有效的方法,而如何将TRT与免疫治疗进行结合则是目前研究的一大热点。美国NIH陈小元研究员、厦门大学郭志德博士、林勤教授和张现忠教授合作提出了一种将基于程序性死亡配体1 (PD-L1)的免疫疗法与基于多肽的TRT (以177Lu为放射性核素)相结合用于对小鼠结肠癌模型进行治疗的策略。
实验结果表明,TRT可以使得T细胞表达的PD-L1增加,并且结合抗-PD-L1抗体(αPD-L1 mAb)后可有效提高CD8+ T细胞的浸润,进而改善对局部肿瘤的控制效果,提高整体存活率并防止肿瘤复发。由此说明该联合治疗是治疗转移性肿瘤的一种有效方法。
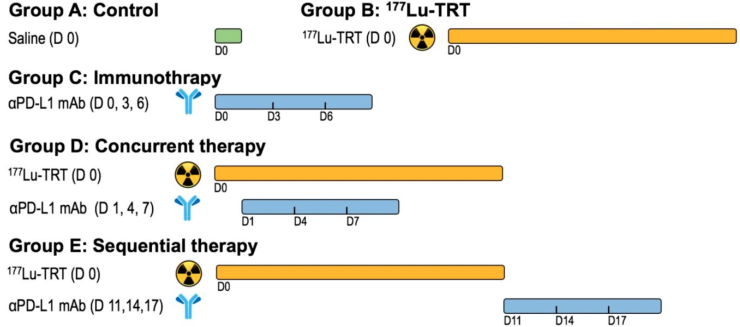
Haojun Chen, Liang Zhao, Xianzhong Zhang, Zhide Guo, Qin Lin, Xiaoyuan Chen. et al. Integrin αvβ3-targeted radionuclide therapy combined with immune checkpoint blockade immunotherapy synergistically enhances anti-tumor efficacy. Theranostics. 2019
DOI: 10.7150/thno.39203
https://www.thno.org/v09p7948.htm
4. Angew:DNA酶介导的基因编码传感器用于对活细胞中金属离子的比率成像
基因编码的荧光蛋白可以与金属结合蛋白或多肽相结合进而用于检测金属离子。然而目前这类传感器只能对有限种类的金属离子(如Ca2+和Zn2+)进行检测,其原因在于缺乏可用的金属结合蛋白和多肽以及难以将金属离子的结合转化成为荧光信号的变化。湖南大学张晓兵教授和伊利诺伊大学香槟分校陆艺教授合作报道了一种利用对Mg2+特异性的10-23和对Zn2+特异性8-17 RNA裂解DNA酶来调节荧光蛋白的表达,并将其作为一类新型的金属离子比率荧光传感器。实验证明了DNA酶可以通过裂解绿色荧光蛋白变体Clover2的mRNA来抑制Clover2的表达,而红色荧光蛋白的突变体Ruby2的表达则没有受到影响。
因此可以通过荧光共聚焦成像和流式细胞实验来对Hela细胞中的Mg2+和Zn2+进行检测分析。由此说明,各种对金属特异性的DNA酶,包括Mg2+、 Na+、Cu2+、Zn2+ 、Pb2+、 Hg2+、 Ag+和 UO22+等都可以被应用于对金属离子进行成像,从而显著扩展基因编码的荧光蛋白传感器的检测范围。
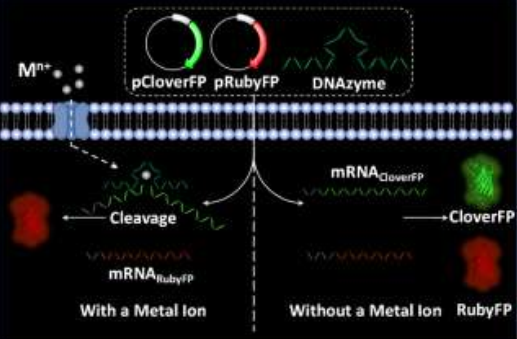
Mengyi Xiong, Zhenglin Yang, Xiao-Bing Zhang, Yi Lu. et al. DNAzyme-Mediated Genetically Encoded Sensors for Ratiometric Imaging of Metal Ions in Living Cells. Angewandte Chemie International Edition. 2019
DOI: 10.1002/anie.201912514
https://onlinelibrary.wiley.com/doi/abs/10.1002/anie.201912514
5. Angew:响应型外泌体纳米生物偶联物用于肿瘤的协同治疗
外泌体在肿瘤的治疗领域中具有很好的应用潜力。然而,天然的外泌体往往在体内的应用效果不佳,通常仅用于作为药物的递送载体。新加坡南洋理工大学浦侃裔教授和北京理工大学谢海燕教授合作构建了一种响应型外泌体纳米生物偶联物,并将其用于肿瘤的协同治疗。实验通过对pH敏感连接器将叠氮修饰的源于M1巨噬细胞的外泌体与DBCO修饰的抗体 (aCD47和aSIRPα)相偶联。在被给药后,这种外泌体纳米生物偶联物可以通过特异性识别肿瘤细胞表面的CD47而主动靶向肿瘤。
并且在酸性的肿瘤微环境下,该偶联物可以释放aSIRPα和aCD47来分别对巨噬细胞上的SIRPα和癌细胞上的CD47进行阻断,使得癌细胞停止发出“不要吃我”的信号,并能有效提高巨噬细胞的吞噬作用。同时,该外泌体也能将巨噬细胞从促进肿瘤发展的M2表型转变为抗肿瘤的M1表型,因此该外泌体生物偶联物具有很好的协同抗肿瘤作用。
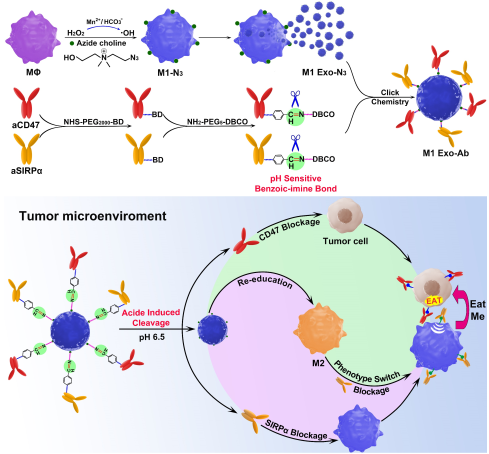
Weidong Nie, Kanyi Pu, Hai-Yan Xie. et al. Responsive exosome nano-bioconjugates for synergistic cancer therapy. Angewandte Chemie International Edition. 2019
DOI: 10.1002/anie.201912524
https://onlinelibrary.wiley.com/doi/abs/10.1002/anie.201912524
6. Angew:逐层构建的纳米颗粒用于肿瘤诊疗
逐层构建的(LbL)纳米颗粒是一种模块化的药物递送载体,可以很好地将多种功能材料相结合。麻省理工学院Paula T. Hammond教授团队将多组分和具有肿瘤靶向能力的LbL纳米颗粒与生物传感肽相结合进而构建了一类新的纳米药物。
这些纳米颗粒中封装有很多的siRNA,而其表面携带的生物传感肽会在肿瘤微环境中被过表达的特定蛋白酶裂解进而可以在尿液中被检测,因此它可以对转移性肿瘤的分子特征和预后不良相关的MMP9蛋白酶过表达情况进行分析。实验在三种不同癌症的小鼠模型上证明了该纳米平台可以对癌症进行非侵入性的尿液诊断以及通过基因沉默的方式治疗肿瘤。
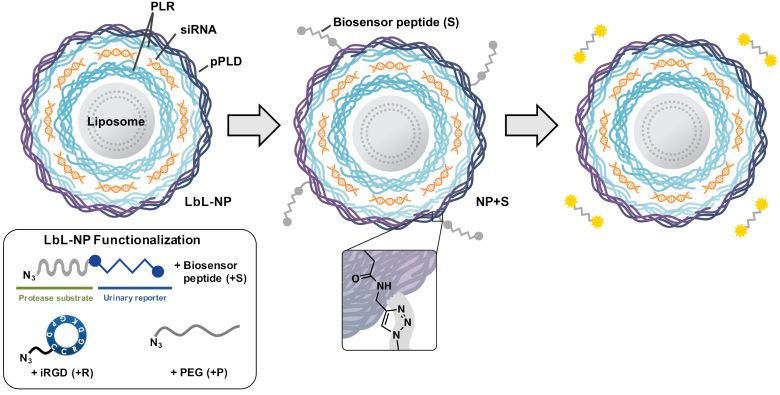
Natalie Boehnke, Santiago Correa, Paula T. Hammond. et al. Theranostic Layer-by-Layer Nanoparticles for Simultaneous Tumor Detection and Gene Silencing. Angewandte Chemie International Edition. 2019
DOI: 10.1002/anie.201911762
https://onlinelibrary.wiley.com/doi/abs/10.1002/anie.201911762
7. Chem. Soc. Rev.:双水相体系的界面研究及其生物医学应用
双水相体系(ATPSs)近年来被广泛用于对生物分子和细胞进行提取、分离、纯化和积累,它们可以通过相分离来构建水-水界面,而这些界面也在生物医学领域有着很好的应用前景。
香港大学Ho Cheung Shum教授团队综述了关于水-水界面的动力学、界面辅助设计的人工细胞、制备生物相容性微粒子、3D生物打印、细胞与生物分子的微流体分离等方面的研究进展;并就如何在更广泛地利用ATPSs及其界面的独特性能进行了详细讨论。
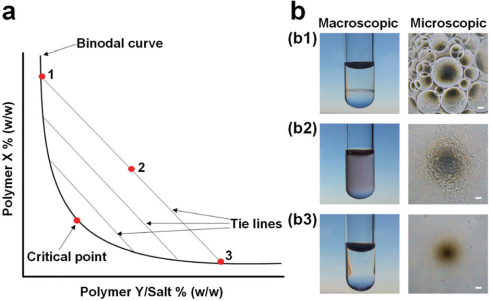
Youchuang Chao, Ho Cheung Shum. et al. Emerging aqueous two-phase systems: from fundamentals of interfaces to biomedical applications. Chemical Society Reviews. 2019
DOI: 10.1039/C9CS00466A
https://pubs.rsc.org/en/content/articlelanding/2019/cs/c9cs00466a#!divAbstract
8. Biomaterials:特异性上转换纳米光敏剂用于对深部肿瘤的光学成像及治疗
治疗副作用是影响肿瘤临床治疗成功与否的主要因素之一。接受光动力治疗(PDT)的患者往往由于光敏剂在体内的血液循环时间较长而产生光毒性,因此其在治疗后的几天内还需要避免光的照射。中科院长春光学精密机械与物理研究所常钰磊研究员和阿姆斯特丹大学张宏教授合作制备了一种新型纳米光敏剂,即利用含有过量光敏剂和猝灭分子的pH敏感型聚合物层将负载有光敏剂的发光上转换纳米粒子自组装成纳米球。
这种设计使其可以控制治疗功能的关闭或者打开,即它在体内循环的过程中进行仅发挥成像的作用,而这一性能可归因于该纳米球具有的pH敏感型外壳和对近红外(NIR)光子的上转换性能。一旦该纳米球被癌细胞吸收内化,其在酸性微环境的作用下就会激活PDT的发生。这一设计可以有效地防止光敏剂在富集和靶向的肿瘤过程中产生光毒性,使得成像指导的对深部肿瘤患者的PDT更加安全,并也有望推广到其他的治疗模式当中。
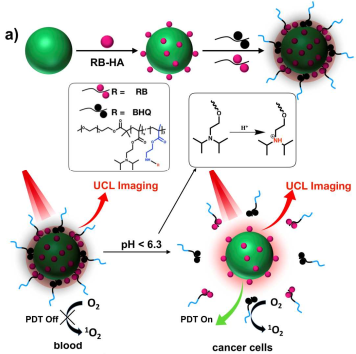
Yansong Feng, Yulei Chang, Hong Zhang. et al. Optical Imaging and pH-awakening Therapy of Deep Tissue Cancer Based on Specific Upconversion Nanophotosensitisers. Biomaterials. 2019
https://www.sciencedirect.com/science/article/pii/S0142961219307367
9. Biomaterials:对pH和超声响应的仿生纳米平台用于气体-声动力联合治疗
声动力疗法(SDT)由于其具有更好的组织穿透性,已迅速发展成为一种可以替代传统光动力疗治疗的有效疗法。但由于肿瘤乏氧微环境的限制,单次的SDT治疗往往不能根治肿瘤。为了解决这一问题,华中科技大学赵元弟教授团队开发了一种对pH和超声响应、同源靶向、低光毒性的仿生纳米平台,用于实现SDT-一氧化氮(NO)气体的联合治疗。该纳米平台由ZIF8材料与亚硝基谷胱甘肽(GSNO)和Ce6组成,其表面包裹有同源肿瘤细胞的细胞膜。
体内外实验结果表明,该仿生纳米平台具有良好的生物相容性,可以通过同源靶向作用实现较高的肿瘤富集效果。并且,它可以在酸性肿瘤微环境中持续释放包裹的药物,而超声(US)刺激也能加速其降解。此外,由US触发的GSNO释放NO和Ce6产生的活性氧可以发挥协同作用产生以抑制肿瘤的生长。而通过反复的US刺激,肿瘤的乏氧微环境也可以得到较长时间的缓解,从而进一步增强治疗的效果。
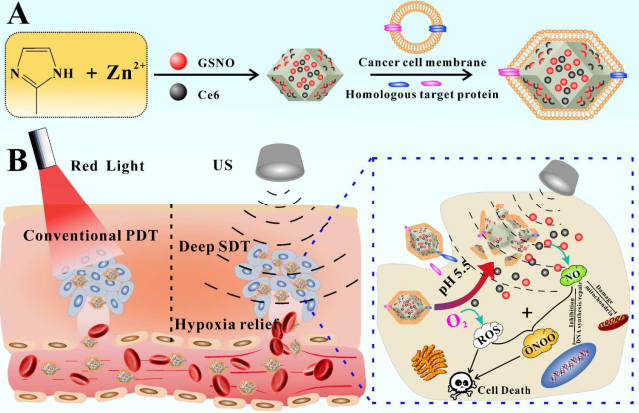
Jie An, Yuan-Di Zhao. et al. A pH/Ultrasound Dual-Response Biomimetic
Nanoplatform for Nitric Oxide Gas-Sonodynamic Combined Therapy and Repeated Ultrasound for Relieving Hypoxia. Biomaterials. 2019
https://www.sciencedirect.com/science/article/pii/S0142961219307355
10. Biomaterials综述:磷脂聚乙二醇基衍生的功能化偶联物修饰纳米材料用于疾病诊疗
近年来,磷脂聚乙二醇衍生的功能化偶联物因具有良好的生物相容性、较长的血液循环特性和良好的靶向性而被广泛应用于修饰各种纳米材料。大量的体内研究表明,被磷脂聚乙二醇衍生的功能化偶联物修饰的纳米药物具有更好的靶向细胞或者组织的性能。
通常来说,包括小分子配体、多肽、蛋白质和抗体在内的靶向分子都可以被偶联到聚乙二醇化的磷脂上来对脂质体、胶束、混合纳米颗粒、纳米复合物或纳米乳剂进行修饰,以实现将诊断和治疗药物靶向地递送到病变部位。第三军医大学张定林教授和张建祥教授合作,对磷脂-聚乙二醇衍生的功能化偶联物的合成方法以及被修饰的纳米药物的生物、物理和化学性质进行了综述;详细介绍了影响纳米药物靶向效果的因素及其在体内的诊疗应用。
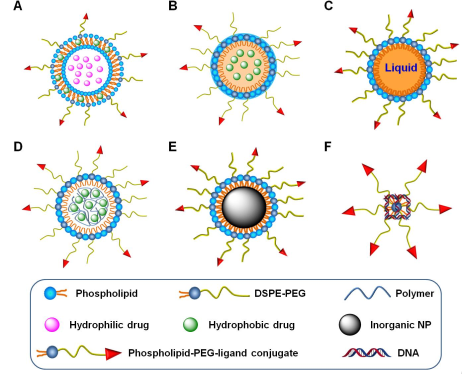
Dinglin Zhang, Jianxiang Zhang. et al. Surface engineering of nanomaterials with phospholipid-polyethylene glycol-derived functional conjugates for molecular imaging and targeted therapy. Biomaterials. 2019
https://www.sciencedirect.com/science/article/pii/S0142961219307458
11. Theranostics综述:微纳米气泡辅助的超声用于增强EPR效应及诊疗相关应用
通过纳米载体向肿瘤递送药物的相关研究都往往会涉及到EPR效应。众多研究表明很多种类型的纳米药物都可以通过EPR效应在实体肿瘤中富集。然而,由于肿瘤存在异质性,EPR效应也是一种不稳定的现象,常常会导致临床实验的药物递送效率很低。研究表明,以微纳米气泡作为造影剂的超声可以破坏血管从而增强药物的特异性递送效果,因此它也是提高EPR效应增强被动靶向肿瘤效果的一种有效途径。
东南大学顾宁教授团队简要介绍了超声的热效应、声流和气穴现象的机理以及这些特性对EPR效应的增强;讨论了微纳米气泡增强的超声成像以及EPR效应的有效性和可变性;综述介绍了一些可以EPR效应介导的被动靶向的智能化气泡给药系统以及最新的发展趋势;最后对开发下一代微纳米气泡用于增强超声诊疗及EPR效应介导的被动靶向的药物递送所面临的主要挑战。
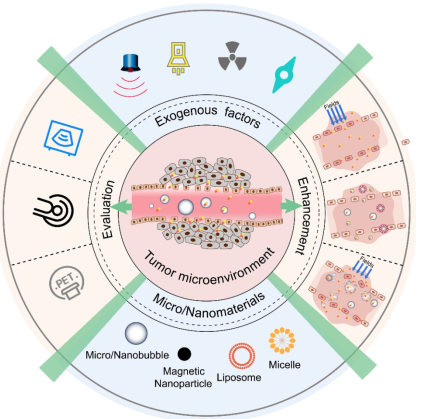
Lei Duan, Li Yang, Ning Gu. et al. Micro/nano-bubble-assisted ultrasound to enhance the EPR effect and potential theranostic applications. Theranostics. 2019
DOI: 10.7150/thno.37593
https://www.thno.org/v10p0462.htm
12. Biomaterials:表面功能化TiO2纳米管以增强骨髓间充质干细胞的成骨分化
为了增强骨内钛(Ti)移植物的临床性能,研究人员在最近开发了大量的微纳米表面结构以对其进行改善。第四军医大学陈丽华教授团队采用阳极氧化法制备了簇状TiO2纳米管结构,并利用血小板衍生生长因子- BB对其进行功能化修饰。
由此产生的三维空间仿生结构NTPCP对宿主细胞的细胞毒性很低,且具有很好的生物活性,并可以显著增强人骨髓间充质干细胞(bMSCs)的附着和成骨的相关功能。体内实验表明,NTPCP可以使得大鼠模型的骨钙素(OCN)表达显著升高,并且植入体周围的骨形成也有明显增强。
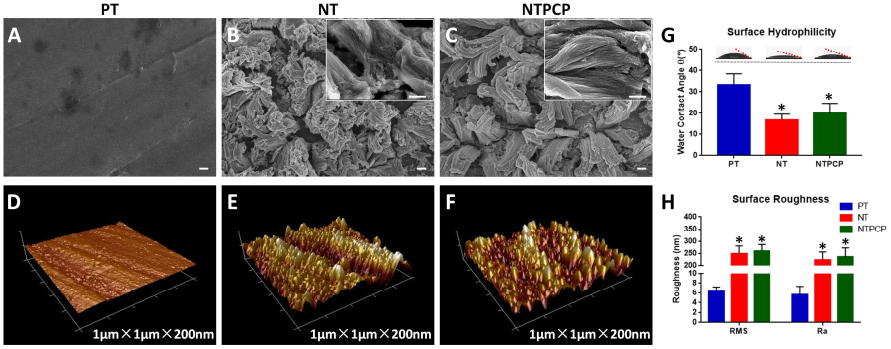
Qianli Ma, Nan Jiang, Shuang Liang, Lihua Chen. et al. Functionalization of a clustered TiO2 nanotubular surface with platelet derived growth factor-BB covalent modification enhances osteogenic differentiation of bone marrow mesenchymal stem cells. Biomaterials. 2019
https://www.sciencedirect.com/science/article/pii/S0142961219307495
13. Nano. Today综述 :具有增强的肿瘤穿透性的纳米工程药物
由于具有多种优势,纳米药物在临床上被广泛用于增强化疗的疗效,但往往效果一般。其中的主要原因是由于肿瘤微环境的特异性,如血供不足、肿瘤细胞和细胞外基质密度高和间质液压力增高等。近年来,许多研究报道了一些可以提高纳米药物在肿瘤内穿透效果的策略,包括调节肿瘤微环境和优化纳米颗粒的性能等等,但这些策略也都有着各自的局限性。
近年来,随着肿瘤穿透肽介导的细胞外转运等策略的出现,多功能可转变的纳米颗粒已成为具有优越的肿瘤穿透能力的新一代纳米药物。新加坡生物工程与纳米科技研究院Su Seong Lee研究员和中科院长春应化所陈学思院士合作对纳米药物的最新发展趋势和具有的局限性进行了综述,并对提高其在肿瘤内穿透性的策略进行了详细的讨论和展望。
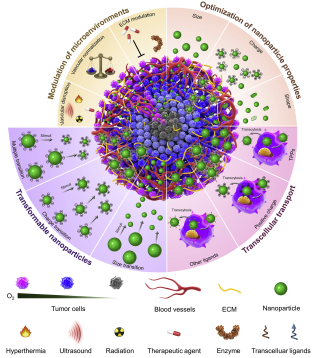
Jianxun Ding, Jinjin Chen, Liqian Gao, Su Seong Lee, Xuesi Chen. et al. Engineered nanomedicines with enhanced tumor penetration. Nano Today. 2019
https://www.sciencedirect.com/science/article/pii/S1748013219303470
14. Nano. Today综述:基于纳米颗粒的磁/光热技术用于癌症治疗
纳米科学的发展为有效对抗癌症提供了许多新的模式。其中,磁热疗和光热治疗技术是两个重要的代表性技术。英国伦敦大学学院Nguyen Thi KimThanh教授团队综述了磁/光热疗的各自机制,并对可以用于磁/光热疗的、具有优异性能的功能性纳米颗粒进行了评估;同时对会影响治疗效果的相关细胞内或细胞外的因素进行了阐释,详细介绍了治疗所使用的仪器和对应的技术细节,并对磁热疗和光热治疗技术进行了比较从而进一步推动二者的联合使用以治疗癌症。
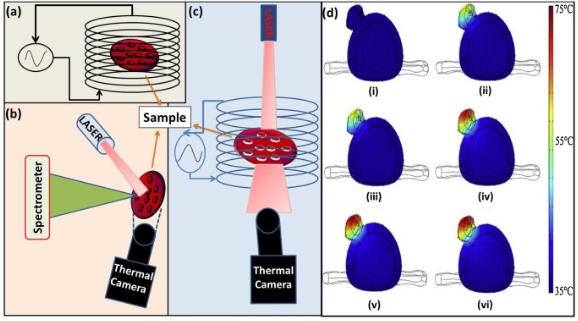
S.K.Sharma, Nguyen Thi KimThanh. et al. Nanoparticles-based magnetic and photo induced hyperthermia for cancer treatment.
https://www.sciencedirect.com/science/article/pii/S174801321930115X
15. Chem. Sci.综述:可被激活的分子试剂用于癌症诊疗
融合了诊断和治疗功能的诊疗一体化试剂因其可以实现个性化治疗和对治疗结果进行实时监测而研究人员的备受关注。而诊疗一体化试剂往往要同时具备靶向、成像和治疗的功能。其中,可被活化的分子试剂(AMAs)因具有较高的信噪比、实时检测肿瘤相关生物标志物、较低的正常组织毒性和较高的治疗效果等优势,是一类很有前途的肿瘤诊疗材料。
西北大学张健健博士和新加坡南洋理工大学浦侃裔教授合作综述了近年来AMAs的研究进展,包括成像指导的化疗、光动力治疗和光热治疗等;介绍了分子设计的重要原理、诊疗机制和生物医学应用;并讨论了AMAs在癌症诊疗领域所面临的挑战的发展前景。
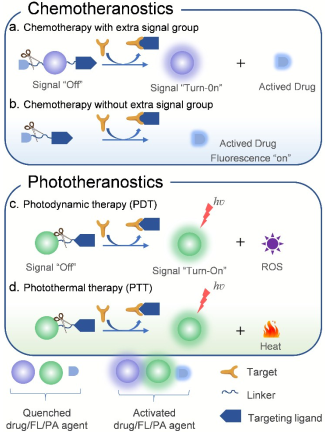
Jianjian Zhang, Lulu Ning, Kanyi Pu. et al. Activatable Molecular Agents for Cancer Theranostics. Chemical Science. 2019
DOI: 10.1039/C9SC05460J
https://pubs.rsc.org/en/content/articlelanding/2019/sc/c9sc05460j#!divAbstract











