导读:在对比电催化剂的催化性能时,过电位是一个非常重要的对比项。当测试千辛万苦制备的催化剂后发现,其过电位低于参考文献中的值,我们都会喜大普奔,大声疾呼制备得到了高性能的催化剂,是不是要发Science了?然而当遇到自己制备催化剂的过电位高于参考文献中的值时,我们一般会怀疑自己的制备方法是不是不对,设计思路是不是存在缺陷,而很少会考虑性能测试方法和过程是否存在问题。
人人皆做电催化,随手一查,相关论文至少几万篇。然而,许多细节问题,却依然没有得到足够的重视。有缺陷的论文一旦发表,终会害人害己,恶性追逐数据的不断攀比,迟早会耽误整个研究领域的良性发展。

事实上,目前许多电化学测试标准尚不完全统一,而且实验值的测量过程中可能本身存在系统误差,所以,我们在催化剂性能的测试过程中不仅要尽量细致认真,而且要知其然知其所以然,这样才能得到准确可靠的性能数据。
接下来的内容,介绍了如何准确地测量电催化剂的过电位,希望通过学习,可以帮助你冷静看待电催化剂的过电位数据,了解过电位的来源,明白测试误差的原因,掌握准确测量过电位的方法。
由极化导致的过电位,是评估电催化剂活性的重要参数
日益严重的能源危机和环境污染问题引起了人们对开发清洁和可再生能源以减少对传统化石能源的依赖的巨大兴趣。电化学水分解被认为是氢能的重要来源,其中包括两个半反应,即阴极上的析氢反应(HER)和阳极上的析氧反应(OER)。使用氢作为燃料的燃料电池的运行涉及阳极氢的氧化反应(HOR)和阴极的氧还原反应(ORR)。对于上述反应,电催化剂对有效提高反应效率具有重要意义。
在大多数情况下,过电位(η)是传递一定电流密度所施加的电势与热力学电势值之间的差,它被选作评估电催化剂活性的主要参数。
过电位是由于电极的极化而产生的,而电极的极化又可以分为两种:
1. 浓差极化。由于实际电极反应要消耗附近的溶液的溶质(这是理想电极不考虑的),造成浓度下降,而溶液的浓度扩散不及时,导致电极周围溶液浓度下降。于是由Nernst方程,电极电位会发生变化。
2. 活化极化。由于电极反应并不是如理想中的那样迅速,所以当电位达到理论电位,电极反应的速率却仍然很慢。要使速率达到可观的水平,必须升高电位,这就叫活化过电位,而这种效果在气体的析出上非常明显。
目前的过电位测量存在较大的误差
通常,电化学测量是在三电极体系中进行的,其中根据电解质溶液的性质使用合适的参比电极(RE)。在大多数已发表的文献中,从实际应用的参比电极进行的可逆氢电极(RHE)转换均基于简化的理论能斯特方程。但是,研究人员逐渐发现,这种校正方法存在一定的问题,经常会导致电催化活性评估的错误。通过理论能斯特方程计算和使用标准参比电极校准获得的电势误差有时高于30 mV,用不同方法制备但组成相同的催化剂的过电位之差通常在数十毫伏的范围内。因此,通过一种统一而可靠的测试方法报告电催化活性,尤其是过电位值,对于电催化剂的研究非常重要。
有鉴于此,哈尔滨工业大学徐平和李思伟等人进行了三电极体系中不同RE的标准实验校准,以了解测量值与理论值之间的差异,以及电解质条件(例如pH值和温度)如何影响过电位。
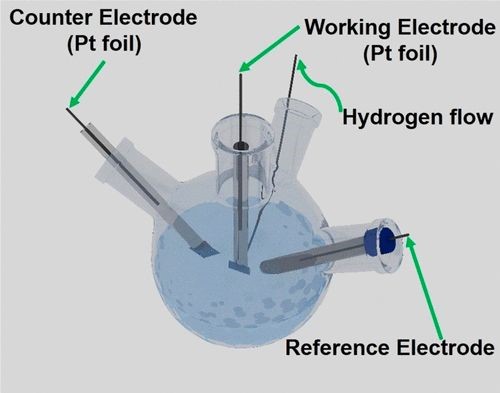
校准测试的条件:选择铂箔(Aldrich)作为工作电极(WE)和对电极(CE)。在进行电极校准之前,将电解质用高纯氢饱和至少30分钟。以1 mV/s的扫描速率进行CV,并将两个相互转换点值的平均值作为热力学势能。对常用的Hg/HgO,Hg/Hg2Cl2和Ag/AgCl参比电极分别选择用于碱性,酸性和中性体系。对每个电极进行了三次平行实验,以消除意外误差。
要点1 Hg/HgO电极的校准
Hg/HgORE通常用于碱性溶液中。校准实验发现,在0.1 M的KOH中,Hg/HgO电极的校正值为0.894V,比从能斯特方程式计算出的理论值大30 mV,这来自于Hg/HgO电极内部的电解质(1M KOH)和工作电解质(0.1M KOH)之间的液接电位(LJP)。在1 M的KOH中,校正值为0.927 V,非常接近理论值(0.924 V)。然而,这并不意味着该公式在这里适用,这实际上是由于1 M KOH的理论和实际pH值之间的差异而导致误差减小。当采用测得的pH值(13.65)进行计算时,计算值比测得值小20 mV。这些结果表明,使用常规理论值导致的误差是不可避免的,但不可忽略。因此,在实验条件下对Hg/ HgO电极进行RHE校准非常重要。
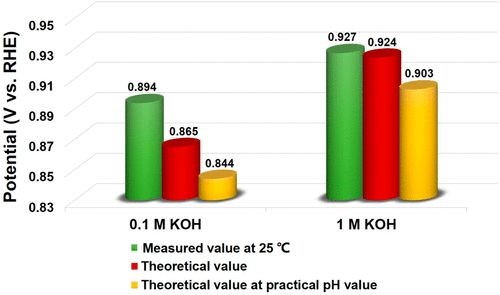
图1 使用不同的方法对Hg/HgO电极进行RHE校准的电势
要点2 Hg/Hg2Cl2电极的校准
Hg/Hg2Cl2电极更适合于酸性体系。在25°C下用不同浓度的H2SO4对Hg/Hg2Cl2电极进行RHE校准。在0.1M H2SO4中,实验和理论校正值分别为0.299 V和0.283 V,在0.5MH2SO4中为0.260 V和0.241V。实验值与理论值之间的差异主要归因于参比电极本身,例如汞的纯度,参比电极内部氧的存在等。
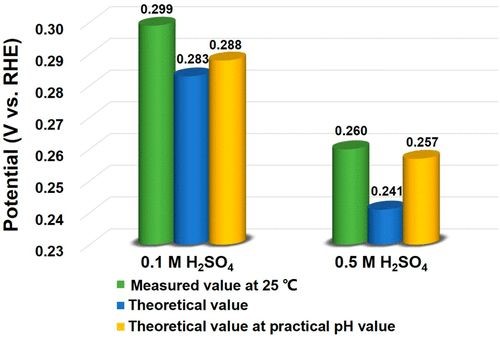
图2 用不同的方法对Hg/Hg2Cl2电极进行RHE校准的电势
要点3 Ag/AgCl电极的校准
Ag/AgCl作为RE适用于中性体系中催化剂性能的测试。在25°C下于0.1 M的Na2SO4溶液中对Ag/AgCl电极进行了RHE校准,校准值为0.706 V,比能斯特方程计算的值大了约90 mV。使用测得的pH值,差异甚至更大(180 mV),如此大的差异主要是由AgCl的溶解引起的,因为Ag/AgCl电极内部的电解质是饱和的KCl,使AgCl容易溶解,而且溶解的AgCl会堵塞参比电极。另外可以看出,与其他两个RE相比,Ag/AgCl电极的测量值和计算值之间的差异要大得多。
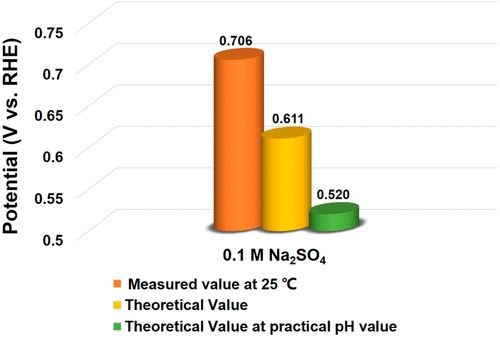
图3 用不同方法对Ag/AgCl电极进行RHE校准的电势
要点4 测试条件对过电位测量有较大影响
实验条件(例如工作温度和实际pH值)对参比电极的校准有较大影响。过电位的校准值随着温度(20、25和30°C)的升高而降低。值得注意的是,所有体系的测试值之间的差异在10 mV以内,因此在大多数情况下可以忽略温度的影响,但过电位极低的电催化剂(例如,贵金属基HER催化剂)和涉及热或光热效应的电催化研究除外。另外,由于电解质的作用,电池的几何形状和电极位置也会影响测得的电势,尤其是当参比电极远离工作电极时。
要点5 多久校准一次参比电极
在三个电极上以不同的时间间隔进行了RHE校准发现,Hg/HgO和Hg/Hg2Cl2电极相对稳定,而Ag/AgCl的电极电位在10天后波动约20mV。另外,REs的稳定性与其制造也有关。因此,针对各种RE的RHE校准不是一劳永逸的过程。
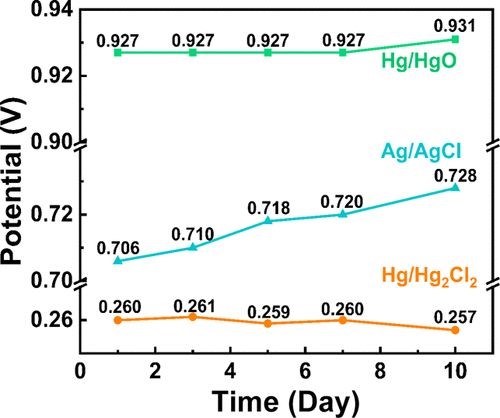
图4 Hg/HgO,Ag/AgCl和Hg/Hg2Cl2参比电极随时间变化的RHE校准电势值
小结
综述所述,在评估电催化剂活性期间需要定期校准参比电极。由于实验条件(例如工作温度和实际pH值)对参比电极的校准有较大影响,因此在测试时也应注意,在论文中应尽量说明清楚。该工作将有助于电催化领域中过电位值的测量和报告的标准化,进一步推动高性能电催化剂的设计研发。
参考文献:
Siqi Niu et al. How to Reliably Reportthe Overpotential of an Electrocatalyst. ACS Energy Lett., 2020.
DOI: 10.1021/acsenergylett.0c00321
https://doi.org/10.1021/acsenergylett.0c00321











