之前,奇物论报道过关于纳米药物进入实体瘤的新机制,里面提及纳米药物进入肿瘤有可能是通过主动途径的,近日,Nature Materials杂志上对此文发表了社论,生物材料大牛David J. Mooney院士发表观点和伊利诺伊大学聂书明教授发表评论文,于此,奇物论针对聂书明教授发表的评述进行解读,里面提及非常好的想法,值得学习!



首先,针对Warren C. W. Chan教授的文章,就不再此重复,读者可去杂志官网找出来收藏收藏,也可点击下方标题查看奇物论的解读:
Nature Materials:挑战传统! 临床30年后,肿瘤纳米给药机制新发现!
下面直接给大家分享聂书明教授在文中给出的重点:
针对Chan及其同事的工作,他们仅使用了一种类型的纳米粒子(胶体金),并且仅研究了三种纳米粒子的尺寸(15 nm,50 nm和100 nm)。具体来说,他们发现对于15 nm的尺寸,EPR效应占肿瘤内部纳米颗粒的12%,对于50 nm的颗粒,EPR效应下降至3%,而对于100 nm的颗粒,EPR效应上升至25%。尺寸依赖性的趋势是违反直觉的,即当纳米颗粒尺寸变小时,通过间隙的被动EPR的贡献有望增加。因此,可能存在更复杂的途径,导致50 nm颗粒的EPR贡献降低。
机制与触发因素:
目前,关于主动转胞吞作用的机制细节,或可能触发细胞摄取、转运和释放穿过血管内皮的纳米颗粒的结构因素,知之甚少。还不清楚纳米颗粒可通过转胞吞作用穿越多少细胞层(即肿瘤组织穿透的深度)。Schnitzer的早期开创性工作(DOI:10.1152/ajpheart.1992.262.1.H246)表明,受体与小窝糖蛋白(例如gp60)结合会导致小窝蛋白介导的内吞作用,并通过转胞吞作用使血白蛋白通过血管内皮细胞主动转运。
浙江大学申有青研究员和UCLA顾臻教授等人的最近的研究(Nature Nanotech. DOI:10.1038/s41565-019-0485-z)表明,电荷翻转过程可以触发小窝蛋白介导的聚合物-药物纳米颗粒的内吞作用和胞吞作用,从而可以在整个实体瘤中进行跨内皮和跨细胞的转运和分布。重要的是,电荷翻转后的正电荷类似于与带正电的TAT肽-量子点。

图|NatureNanotech.
据报道,这些类型的TAT肽涂层的量子点被细胞摄取后,沿微管轨道进行主动的细胞内转运,然后通过胞吐作用或囊泡脱落释放。一个主要发现是分子马达参与细胞内运输,以及伪足参与动态结构重塑,最终将膜结合的量子点从细胞的一侧改组到另一侧。类似地,肿瘤穿透肽已被用于增加药物、抗体和纳米治疗药物在体内实验肿瘤和体外人类肿瘤中的积累。因此,研究这类肽是否可用于触发或促进主动转胞吞作用将是一个有趣的课题。
除了正电荷外,配体-受体结合可能在主动转运的早期阶段很重要。与细胞表面受体的特异性相互作用通过细胞内吞和随后的细胞内释放治疗药物促进纳米颗粒内吞。抗体、核酸、肽甚至碳水化合物等大分子可以附着在纳米颗粒表面进行选择性靶向和转运。随着有关细胞转运是纳米颗粒进入肿瘤的主要途径的报道,配体-受体结合将重新引起人们的兴趣。特别是,了解与空泡(vacuole)形成有关的配体-受体相互作用有助于合理设计用于癌症纳米药物的纳米粒。随着对体内纳米颗粒递送的新见解,我们应该重新思考我们的策略,将我们的重点从仅考虑被动EPR递送的纳米颗粒转移到设计增强主动递送的纳米颗粒。此外,进一步研究细胞介导的递送方法也可以提高纳米粒子进入实体肿瘤的效率(下图c)。

图|Nature Mater.
癌症治疗新方式
除了转胞吞作用之外,纳米增强免疫疗法可以为癌症纳米药物提供完全不同的途径。与其设计纳米颗粒来克服血管内皮的屏障,不如利用免疫细胞来破坏肿瘤。这种方法绕过了长期存在的体内给药问题,通过制备专门刺激免疫系统的纳米颗粒,可以有效穿透实体肿瘤。
在癌症治疗中使用免疫疗法有几个优势。首先,少量免疫细胞的激活有效地增强了对肿瘤细胞的反应。这与传统的化疗药物形成了鲜明对比,这些药物经常大量使用,常常导致非恶性组织的毒性。其次,对肿瘤细胞的免疫反应可以通过之后的免疫记忆来防止随后的复发。第三,活化的免疫细胞可以定位远处的转移灶,而这些转移灶通常是常规疗法无法达到的。
纳米疫苗
目前癌症免疫治疗的方法包括注射免疫检查点阻断剂,例如单克隆抗体,或刺激先天免疫系统。如ipilimumab和atezolizumab等药物已被批准用于多种类型的癌症。但是,这些药物价格昂贵,容易产生耐药性,患者反应也很低。在这方面,免疫治疗剂的靶向递送仍然是有吸引力的。纳米粒子与免疫系统的相互作用已被广泛研究。事实上,以纳米颗粒为基础的疫苗已经有了非常有前途的发展,这种疫苗可以将抗原输送到淋巴腔,最终刺激T淋巴细胞产生抗肿瘤反应。

纳米粒子也适合作为与肿瘤微环境中的两个或多个相关免疫成分进行多特异性相互作用的平台,并与多个免疫伴侣结合以诱导免疫反应。Yuan等人(Nature Nanotech. DOI:10.1038/nnano.2017.69)最近开发了一种用于癌症免疫疗法的多价双特异性纳米生物共轭物接合剂(mBiNE)。作者将具有抗HER2受体和钙网蛋白(CRT)对羧基化聚苯乙烯纳米粒子进行了功能化。当抗HER2与肿瘤细胞上的HER2受体结合时,钙网蛋白与巨噬细胞相互作用以激活它们。纳米粒子的作用就像一个平台,促进癌细胞的参与并激活巨噬细胞,随后还激活T细胞并诱导针对肿瘤细胞的免疫反应。此外,用mBiNE处理导致记忆T细胞的形成,可以消除肿瘤细胞的任何进一步复发。
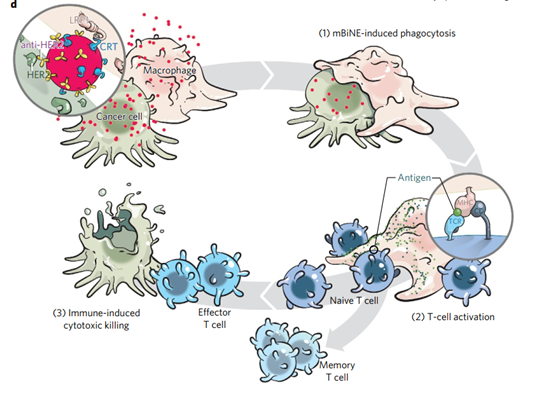
图|Nature Nanotech.
纳米靶向免疫细胞
此外,还开发了一些策略,可以通过在纳米颗粒表面附着特定的部分直接靶向T细胞。Schmid等人(Nature Commun. DOI:10.1038/s41467-017-01830-8)开发了一种基于PLGA/ PEG的纳米粒子系统,该系统旨在以模块化方式靶向T细胞上的多种受体。纳米颗粒还载有可以持续释放的小分子药物。这些基于纳米粒子的多特异性接合剂和靶向药物释放平台的最新实例利用了用一种以上靶向配体对纳米粒子表面进行功能化的潜力
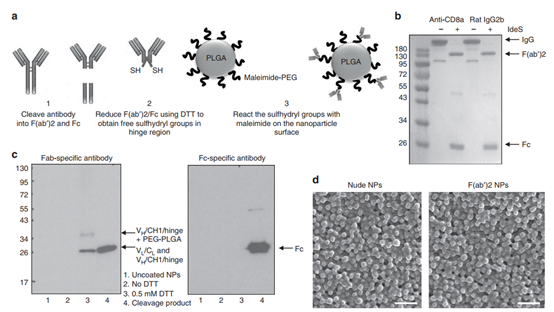
图|Nature Commun.
纳米光热免疫
另外,纳米颗粒独特的光学特性可以与治疗特性相结合,开发用于癌症免疫治疗的多模式药物系统。苏州大学刘庄教授等人开发了一种多模式纳米颗粒系统,该系统结合了光热剂吲哚菁绿(ICG)和封装在聚乳酸-乙醇酸(PLGA)中的toll样受体-7激动剂咪喹莫特(R837)。这种多模式PLGA-ICG-R837结构被证明能够在红外激光照射下消融原发性肿瘤,并且在免疫检查点阻断的情况下,能够进一步消除肿瘤细胞。
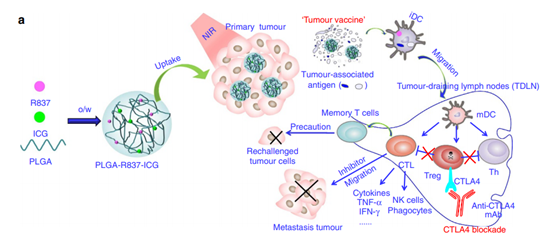
图|Nature Commun.
还有,还开发了强大的免疫记忆能力,可以为后续的肿瘤再复发提供保护。Kulkarni等人(PNAS, DOI: 10.1073/pnas.1603455113)最近报道称,聚合纳米颗粒系统能够与报告模块一起提供免疫治疗有效载荷,以监测所给免疫治疗剂的疗效。聚合物纳米颗粒报告了从其治疗负荷传递到的同一细胞中的caspase-3活性,因此是药物活性的直接量化。但是,应该指出的是,这些多功能或“多才多艺”的纳米粒子通常具有复杂的结构和化学组成,并且可能在临床转化中面临其他挑战。
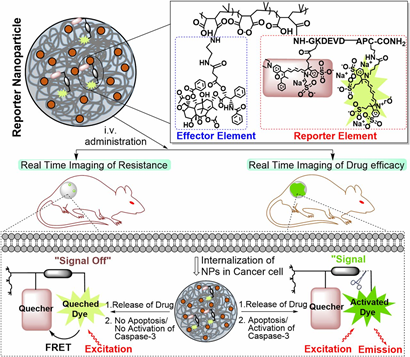
图|PNAS
小结:
总之,Chan和他的同事报道了令人信服的实验证据,表明基于细胞转运的主动机制可能比被动EPR效应更有效,因此可以作为一种主要机制,在实体肿瘤的血管内皮上运输纳米颗粒。这一发现为设计用于体内肿瘤递送和靶向的纳米颗粒创造了新的可能性。然而,要了解主动转运的详细机制和触发这种转运过程的因素,还有很多工作要做。此外,利用多功能纳米颗粒靶向天然和适应性免疫系统为癌症纳米医学提供了新的途径,从而绕过了纳米颗粒进入实体肿瘤的长期瓶颈。就临床转化而言,目前尚不清楚主动转胞吞作用是否会促进或阻碍这项任务。如果纳米颗粒的递送效率可以大大提高(例如,提高一个数量级),那么主动的转胞吞作用机制将通过减少纳米颗粒的剂量来提高治疗效果或减少副作用。
参考资料:
Pandit,S., Dutta, D. & Nie, S. Active transcytosis and new opportunities forcancer nanomedicine. Nat. Mater. 19, 478–480 (2020).
https://doi.org/10.1038/s41563-020-0672-1











