近年来,光疗逐渐的成为肿瘤治疗的主要手段。光疗主要包括光热治疗(PTT)和光动力治疗(PDT),对于光热治疗来说,在特定波长下的光照射光热剂,使得光热剂升温从而杀死肿瘤细胞;而对于光动力治疗来说,在特定的光照射下,光敏剂可以产生大量的活性氧自由基(ROS)从而可以杀死肿瘤细胞。光敏剂的使用是光动力疗法的关键组成部分,而光热疗法不需要外源光热造影剂就可以提高治疗效率和疗效。光疗在增加肿瘤治疗效果和减少副作用上面具有巨大的优势,在过去的几十年里,已经开发出了许多光疗药物和设备,但是光疗法面临着表面瘤之外的广泛临床应用的挑战。
近日,美国国立卫生院陈小元教授在Nature Reviews Clinical Oncology上发表综述,概述了癌症光疗法的临床进展,并讨论了新兴的临床前生物工程方法,这些方法有可能克服这一领域的挑战,从而提高此类治疗的效率和效用。

PTT、 PDT作用机制:
在临床环境中,光热剂和光敏剂通常是通过静脉或局部应用给药的。因此,作用过程分别是:(1)以静脉注射的方式向患者注入光热剂或光敏剂。(2)随后,光热剂或光敏剂通过血液循环分布在身体各处。(3)通过主动和/或被动靶向策略以及选择性的分子激活(例如,利用肿瘤微环境中的蛋白酶或缺氧环境)可实现肿瘤组织中PTT或PDT试剂的聚积。(4)利用特定波长的光局部照射到肿瘤组织,时PDT或PTT试剂从基态激发到激发态。(5)PTT或PDT激发后,热损伤或化学损伤引起肿瘤消融。作用过程由图1a表示。其中,热损伤是由激发的PTT试剂在振动弛豫过程中释放的热量引起的,PDT试剂在激发单线态到长寿命三重态的系统间交叉后通过能量和/或电子转移产生的活性氧物种(ROS)引起的(图1b)。用于肿瘤学临床光疗的常见光传输范例。可以使用各种方法,并且可以针对肿瘤的位置和程度进行调整。光敏剂在靶肿瘤中的积累是PDT的先决条件。组织的光渗透高度受到限制,因此,使用多根纤维进行组织间光传输需要用于治疗大和/或深部肿瘤。用于肿瘤临床光疗的常用光传递模式有多种方法可供选择,并可根据肿瘤的位置和范围进行调整。光敏剂在靶肿瘤中的蓄积是PDT的先决条件。光对组织的穿透力非常有限,因此需要使用多个纤维的间质光传输来治疗大型和/或深部肿瘤(图1c)。
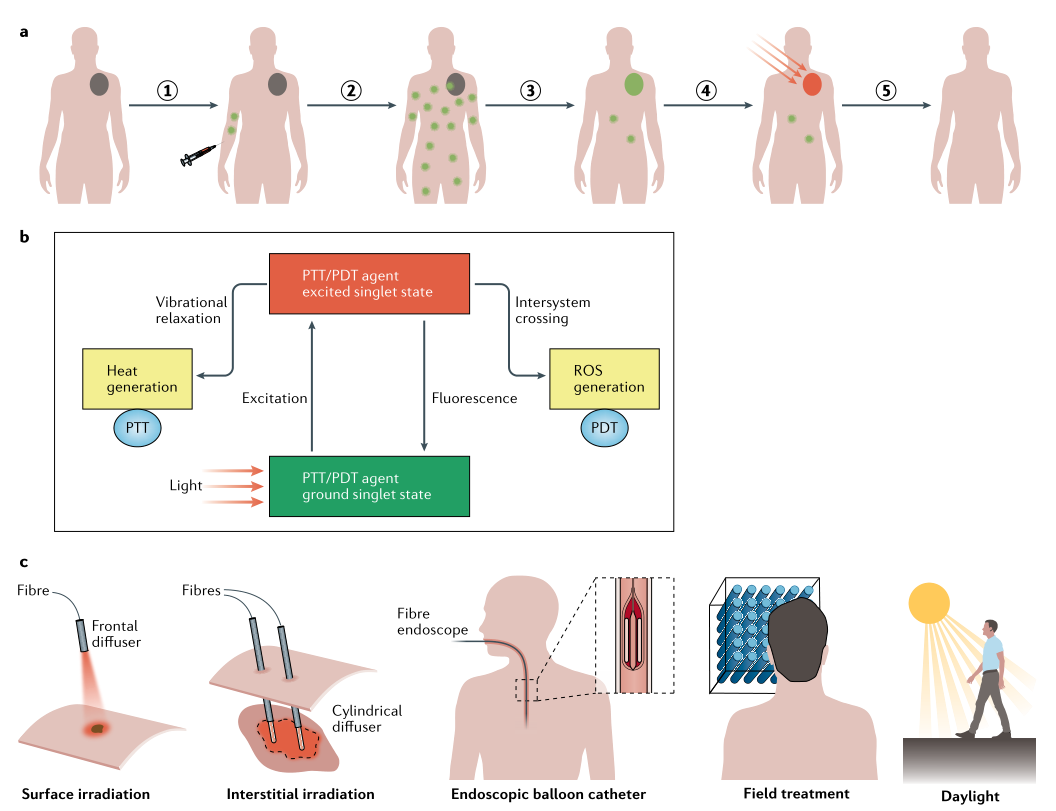
图1. PTT、 PDT作用过程(a)、作用机制(b)及临床常用治疗模式(c)。
PTT、PDT现状:
PDT是基于光敏剂在肿瘤内的局部激活,以诱导化学损伤,从而导致肿瘤细胞死亡;这种方法在临床上已经应用了40多年,用于治疗各种癌症,包括浅表皮肤癌、食道癌和肺癌。PDT还具有治疗其他肿瘤类型的潜力,有针对乳腺癌、头颈癌、胆管癌、膀胱癌、胰腺癌、宫颈癌的临床试验的支持性证据。陈小元教授详细介绍了各种光敏剂在临床上批准的时间及各自的优缺点(图2)。PTT可用于提高局部光加热和肿瘤组织消融的效率,但尚未在大型临床试验中进行测试;无PTT试剂的激光消融已在临床上使用。
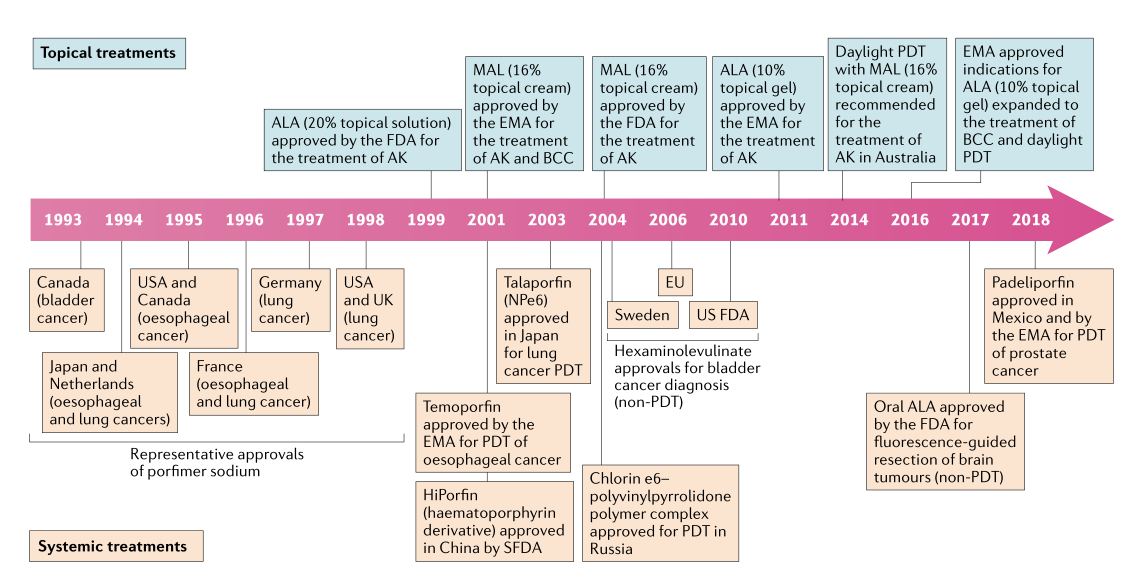
图2. PDT光敏剂的批准时间表。
PTT、PDT靶向策略:
靶向策略可以改善光热剂和光动力剂对肿瘤组织的传递,有可能同时提高PTT和PDT的选择性和有效性,受到广泛关注。目前正在探索被动靶向和主动靶向。被动靶向可通过调节纳米颗粒(或大分子)制剂的大小和表面化学来实现,以通过增强渗透性和滞留(EPR)效应促进其在肿瘤中的选择性积聚。主动靶向通常涉及到高亲和力配体的使用,这些配体与主要由癌细胞或肿瘤上皮细胞表达的特定表面分子结合。各种配体已被探索用于PTT和PDT药物的主动靶向,包括多肽、蛋白质、核酸适配体等(图3)。
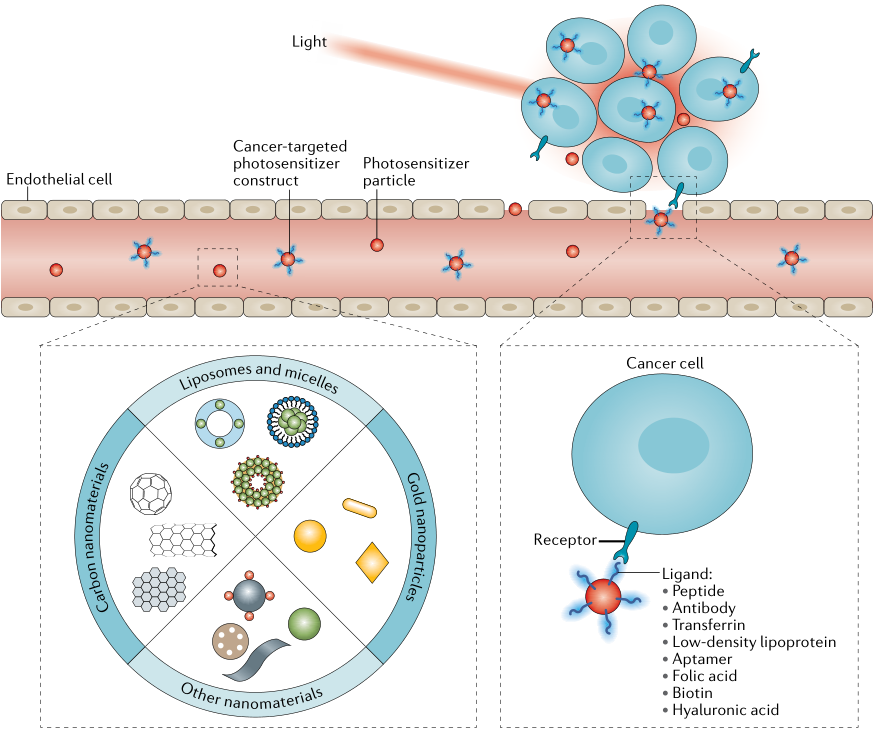
图3. PTT和PDT治疗实例中,利用纳米技术或适配体来靶向肿瘤。
PDT中光敏剂的活化:
在目前的PDT方法中,使用的光敏剂通常是“常开”状态。因此,患者在治疗后必须长时间远离阳光,直到光敏剂从体内排出,以避免健康组织的光敏性和光毒性。例如,经过“常开”光敏剂治疗后,眼睛容易受到光线的影响,皮肤容易晒伤、肿胀和起泡。因此,可活化光敏剂急需被开发。理想情况下,可激活的光敏剂应保持“关”状态,在肿瘤微环境下,被肿瘤相关因子激活到“开”状态,这样确保高度特异的局部PDT反应(图4)。
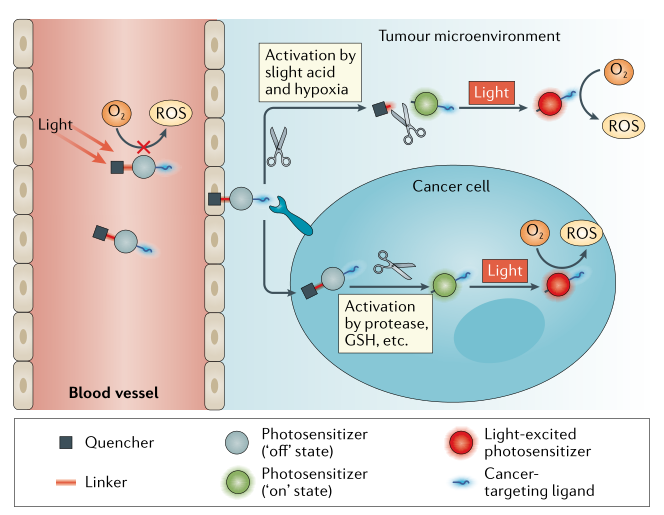
图4. 可活化光敏剂用于特异性PDT来治疗癌症。
PTT、PDT与其他治疗方式联用策略:
单独使用PTT或PDT(尤其是在一个疗程后)很难完全根除实体瘤。因此,PTT和/或PDT与其他治疗方式的结合可以提供利用每种治疗方式的优点,从而产生附加的甚至是协同的治疗效果(图5)。纳米技术在联合治疗方面扮演着重要的角色,因为纳米平台提供了载体,用于整合与不同治疗模式相关的各种制剂。而且,对于光疗联合疗法,如化疗或免疫疗法,已经建立了良好的护理标准;因此,初步的临床研究很可能涉及到将光疗与当前批准的治疗相结合。不同疗法之间的协同作用可能会提高低剂量光敏剂或低功率光照射的抗肿瘤效果,从而最大限度地减少对健康组织的潜在毒性。此外,PTT和PDT联合应用的多模式治疗在对抗多药耐药(MDR)和缺氧相关的肿瘤治疗耐药方面具有广阔的前景。
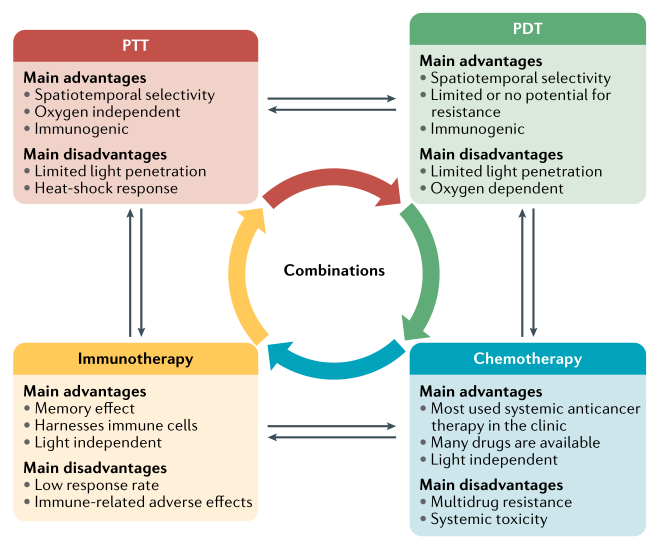
图5. PTT、PDT与其他治疗方式联用来治疗癌症。
小结:
随着临床上对于PDT和PTT兴趣的持续增加,将利用新颖和创新的设计继续开发药物,以提高对肿瘤组织的靶向性和选择性。更重要的是,治疗效率、实用性和与既定模式等都被视为开发工作的关键指标。除了药物本身的进步外,光传递和适应症选择的进展也将是临床成功的关键。随着合理的技术创新和战略改进,新的PDT和PTT平台的临床扩展仍有相当大的空间。
参考文献:
Li, X., Lovell, J.F., Yoon, J. et al. Clinical development and potential of photothermal and photodynamic therapies for cancer. Nat Rev Clin Oncol (2020).
https://doi.org/10.1038/s41571-020-0410-2
陈小元教授:1993年和1996年分别获得南京大学化学学士和硕士学位,随后1999年获得美国爱达荷大学博士学位。经过Syracuse大学和Washington大学圣路易分校博士后训练,于2002年进入南加州大学放射学系任助理教授,2004年转入斯坦福大学,2008年升为副教授。2009年陈博士加入美国国立卫生研究院(NIH)生物医学影像及医学工程所(NIBIB)任终身资深研究员,分子影像及纳米医学实验室主任。2010,2012年获NIBIB Mentor Award, 2014年获 NIH Director’s Award。陈博士的科研方向主要涉及体外诊断,体内成像,基因/药物的纳米载体,以及诊疗一体化。ACS Nano等多家杂志的编委,Theranostics杂志的创刊主编,中美核医学及分子影像学会(CASNMMI)前任主委,中美纳米医学及纳米生物技术学会(CASNN)现任主委。











