1. Chem. Soc. Rev.:生物材料促进过继细胞疗法
近日,新加坡国立大学陈小元、东南大学Jinbing Xie等人综述了生物材料促进过继细胞疗法的最新进展。
基于功能性免疫细胞转移的过继性免疫疗法在治疗多种恶性疾病,尤其是癌症、自身免疫性疾病和传染病方面具有广阔的前景。然而,生产问题和生物屏障导致过继转移后患病部位的靶选择性效应细胞数量不足,阻碍了有效的临床转化。免疫学、细胞生物学和材料科学的融合为开发基于生物材料的工程平台以克服这些挑战奠定了基础。可以合理设计生物材料以改善体外免疫细胞扩增、加速功能工程、促进免疫细胞原位保护性递送以及在体内引导注入的细胞。
于此,这篇综述全面总结了基于生物材料的策略以提高过继细胞治疗的疗效的最新进展,重点关注功能特异性生物材料设计,并讨论了该领域的挑战和前景。
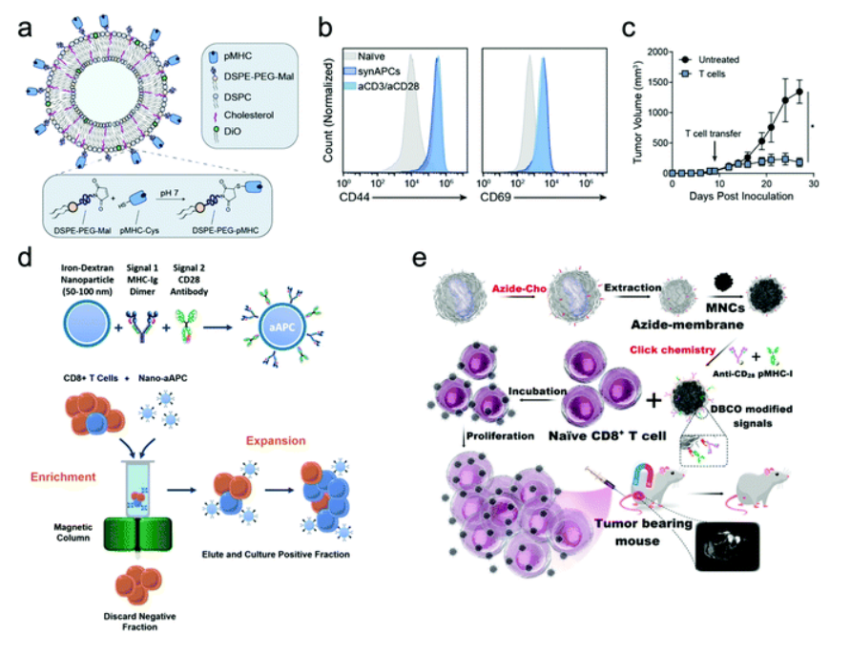
Recent advances in biomaterial-boosted adoptive cell therapy. Chem. Soc. Rev. 2022.
https://doi.org/10.1039/D1CS00786F
2. Adv. Mater: 抗体结合纳米药物用于癌症治疗
近日,新加坡国立大学陈小元等人综述了用于癌症治疗的抗体结合纳米药物的相关进展
基于抗体的癌症治疗是最重要的治疗策略之一,在过去几十年中取得了相当大的成功和进步。然而,对于基于抗体的癌症治疗,包括有限的肿瘤穿透、短的循环半衰期、不希望的免疫原性和脱靶副作用等障碍仍有待克服。由于纳米技术的快速发展,已被广泛探索以克服这些障碍的含抗体纳米药物已被证明具有增强的抗癌功效和临床转化潜力。
本综述旨在概述结合抗体的纳米颗粒系统在癌症治疗中的进展,以及这些下一代纳米药物所面临的重大挑战。本综述提供并讨论了多种抗体固定策略、抗体形式、癌症相关抗原类型以及含抗体纳米药物的抗癌机制,重点介绍了最新应用。还从不同的角度讨论了目前含抗体纳米药物的局限性和未来的研究方向,为抗癌纳米药物的构建提供新的见解。
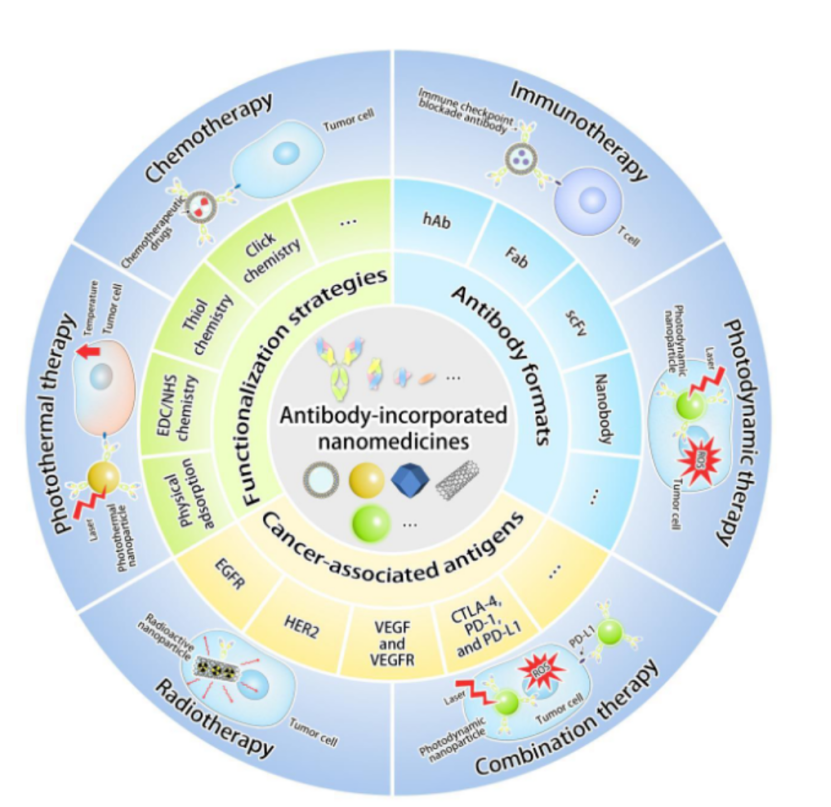
Wu, S.-Y., Wu, F.-G. and Chen, X. (2022), Antibody-Incorporated Nanomedicines for Cancer Therapy. Adv. Mater.. 2022.2109210.
https://doi.org/10.1002/adma.202109210
3. Adv. Mater:混合膜修饰的普鲁士蓝可通过肿瘤相关巨噬细胞极化和乏氧缓解以用于癌症免疫治疗
肿瘤相关巨噬细胞(tumor associated macrophages, TAMs)和乏氧等因素都会严重影响免疫治疗的抗肿瘤能力。如何克服这两个问题也是提高免疫治疗效果的关键。郑州大学侯琳教授、杨炜静教授和新加坡国立大学陈小元教授构建了一种具有甘露糖修饰和羟基氯喹(HCQ)吸附的中空介孔普鲁士蓝(HMPB)纳米体系Man-HMPB/HCQ。
本文要点:
(1)该纳米体系可以通过甘露糖受体介导的内吞作用以促进细胞内化,并通过HMPB降解释放铁离子/HCQ以及诱导TAM极化。实验将巨噬细胞和类囊体(TK)混合膜“伪装”修饰在Man-HMPB/HCQ表面,从而制备得到TK-M@Man-HMPB/HCQ,以减少该纳米体系在体内网状内皮系统中的摄取,增强在肿瘤内的积聚效果,进而缓解乏氧。
(2)体内结果表明,TK-M@Man-HMPB/HCQ能够显著抑制肿瘤生长,诱导TAM极化,促进细胞毒性T淋巴细胞浸润和缓解乏氧微环境。综上所述,该研究表明合理设计的纳米系统可为调节肿瘤微环境以增强肿瘤免疫治疗提供新的策略。
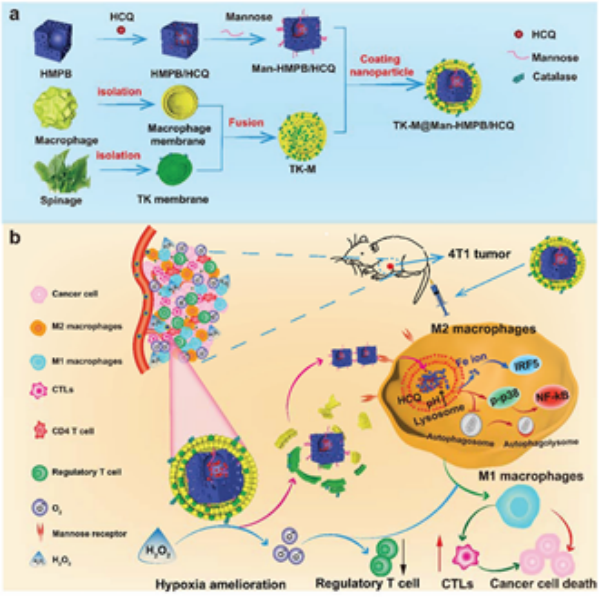
Lin Hou. et al. Hybrid-Membrane-Decorated Prussian Blue for Effective Cancer Immunotherapy via Tumor-Associated Macrophages Polarization and Hypoxia Relief. Advanced Materials. 2022
DOI: 10.1002/adma.202200389
https://onlinelibrary.wiley.com/doi/10.1002/adma.202200389
4. Angew:NIR-II有机造影剂的化学研究
北京大学深圳医院尹玉新教授、穆婧研究员和新加坡国立大学陈小元教授对有关NIR-II有机造影剂的化学研究进展进行了综述介绍。
本文要点:
(1)与正电子发射断层成像(PET)和磁共振成像(MRI)相比,光学成像,特别是荧光和光声成像具有无创、高时空分辨率和高灵敏度等特点。由于近红外II(NIR-II)区成像具有穿透深度更深、信噪比高、分辨率高和组织损伤小等优点,因此越来越多的研究人员开始致力于开发和设计具有NIR-II吸收或发射的造影剂。
(2)作者在文中对近年来发展起来的有机发光/光声材料(从小分子到共轭聚合物)进行了综述;随后,作者系统地介绍了其成像性能以及工程化策略,并按骨架内核对其进行了分类;最后,作者对这些NIR-II有机染料在临床应用中所面临的挑战和发展前景进行了讨论。旨在为推动NIR-II造影剂的进一步发展起到提供借鉴和启发。
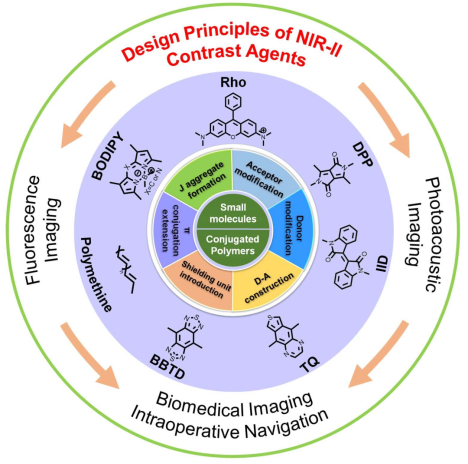
Jing Mu. et al. The Chemistry of Organic Contrast Agents in the NIR-II Window. Angewandte Chemie International Edition. 2021
DOI: 10.1002/anie.202114722
https://onlinelibrary.wiley.com/doi/10.1002/anie.202114722
简介:

陈小元,1999年获得美国爱达荷大学博士学位,曾先后在Syracuse大学和Washington大学圣路易分校进行博士后研究,于2002年进入南加州大学放射学系任助理教授,2004年转入斯坦福大学,2008年升为副教授,2009年加入美国国立卫生研究院(NIH)生物医学影像及医学工程所(NIBIB)任终身资深研究员,分子影像及纳米医学实验室主任。陈教授于2020年加入新加坡国立大学医学院和工程学院,任终身Nasrat Muzayyin讲席教授。
陈教授的科研方向主要涉及体外诊断,体内成像,基因/药物传输的生物材料,以及诊疗一体化等生物医学领域研究。陈教授已发表850多篇SCI论文(H-index 152,引用率 > 84000) ,在Nat. Nanotechnol.; Nat. Rev. Mater.; Nat. Rev. Clin. Oncol.; Nat. Biomed. Eng.; Nat. Commun.; Proc. Natl. Acad. Sci. U S A; Adv. Mater.; J. Am. Chem. Soc.; Angew. Chem. Int. Ed.等顶级杂志发表大量研究成果,部分研究成果已经转化并进入临床研究阶段。陈教授是Theranostics杂志的创刊主编(2020年影响因子8.579), Acc Chem Res, ACS Nano, J Nucl Med等多家杂志的编委,曾任中美核医学及分子影像学会(CASNMMI)主委,中美纳米医学及纳米生物技术学会(CASNN)主委,以及美国核医学及分子影像学会(SNMMI),Radiopharmaceutical Science Council (RPSC)主委,获NIBIB Mentor Award, ACS Bioconjugate Chemistry Lecturer Award, AIMBE Fellow, SNMMI Fellow等多个荣誉。











