
第一作者:孟周琪
通讯作者:刘庄
通讯单位:苏州大学、东华大学、山东师范大学
研究亮点:
1. 制备高效的近红外激光激活的混合水凝胶系统CuS/131I-PEGDA/AIPH。
2. 该系统可以有效提高CuS/131I的瘤内保留并多次持续改善瘤内乏氧来增强放射治疗效果。
通过将治疗性放射性物质放入肿瘤或附近的区域中进行治疗的短距离放射治疗。在这一治疗方案中,生成的氧自由基被用于来攻击生物分子如DNA,然后杀死肿瘤细胞。因此与外束放射治疗相似,氧也在增强和诱发短距离放射治疗中癌症细胞的死亡方面起着关键作用。
然而,由于实体肿瘤微环境的缺氧性质,乏氧的肿瘤细胞比正常细胞更能抵抗辐射,从而导致了这一治疗方法对某些类型的癌症的治疗效果很差。此外,在一些临床病例中,局部植入放射源例如125I可能无法为整个肿瘤提供同质均匀的剂量分布,也会导致短距离放射治疗效果不佳。
由于水凝胶能够将生物活性物质封装在前体中,然后将其转化为针对目标病灶(如肿瘤)的交叉连接的水凝胶网络,从而使长期的药物释放能够持续地保留的特点使得其获得了研究人员的极大关注。由此可以设想制备在肿瘤内实现溶胶-凝胶转换的放射性同位素胶囊,对于改善易于操作的短距离放射治疗效果来说会很有帮助。
目前有不同的方法来触发体内的水凝胶的原位形成,如光,和特定的酶。在这些策略中,使用光引发剂触发聚合的光诱导凝胶具有突出的优势,因为它可以在时间和空间的精度下进行调控。然而,大多数光引发剂都只能被短波长的光源所激发,而这些光源的组织穿透深度十分有限。因此发展近红外(NIR)光激活的水凝胶系统,将有希望能够改善治疗型放射性同位素在肿瘤内的控制方式,同时有助于克服由于乏氧造成的实体肿瘤的辐射抗性。
有鉴于此,苏州大学刘庄教授课题组利用混合水凝胶体系,有效提高了CuS/131I的瘤内保留并多次持续改善瘤内乏氧来增强放射治疗效果。
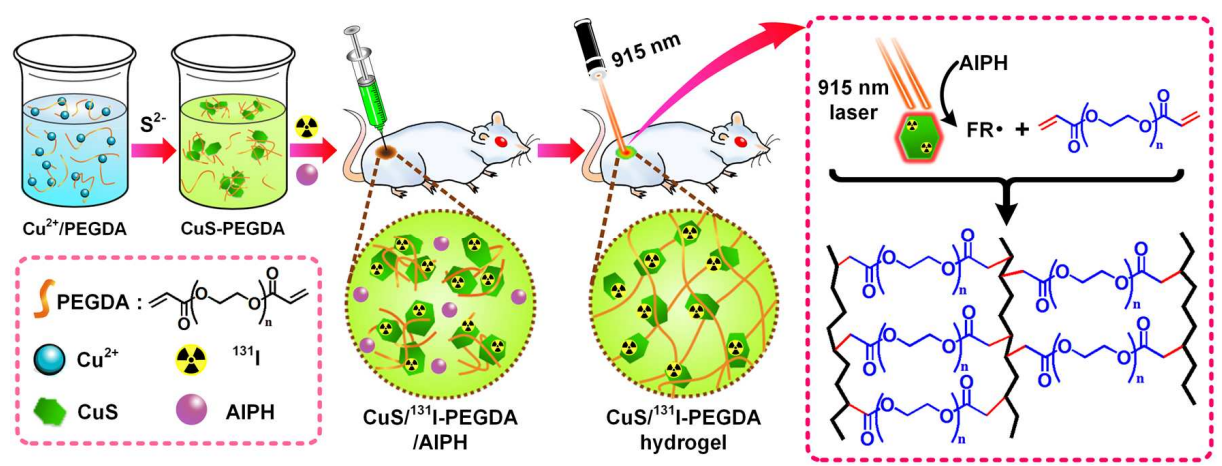
图1 瘤内原位合成CuS/131I-PEGDA水凝胶的示意图
该课题组使用131I标硫化铜(CuS/131I)纳米粒子作为光热-放射疗法的试剂;聚乙二醇双丙烯酸酯(PEGDA)作为聚合物基体;AIPH作为热引发剂来实现光致原位凝胶光热-短距离放射联合治疗肿瘤。CuS/131I在915 nm激光辐照下会产生热量适度地提高肿瘤温度,并通过激活AIPH热引发剂来启动PEGDA聚合,有效地通过原位凝胶化将CuS/131I固定在肿瘤内。通过对肿瘤的反复照射,缺氧可以得到长期有效的缓解,从而产生显著的协同光热效应消除肿瘤。
在这一工作中,亲水性的CuS-PEGDA NPs在水溶液中利用原位共同沉淀方法来合成。在透射电子显微镜下观察发现CuS NPs直径在5-10 nm,进一步被PEGDA封装形成50-70 nm大小的CuS-PEGDA。而高分辨率TEM(HRTEM)图像显示了CuS清晰的晶格边缘,其平面间的d间距为2.81 Å,与CuS的六角形结构的(103)晶格边缘一致。
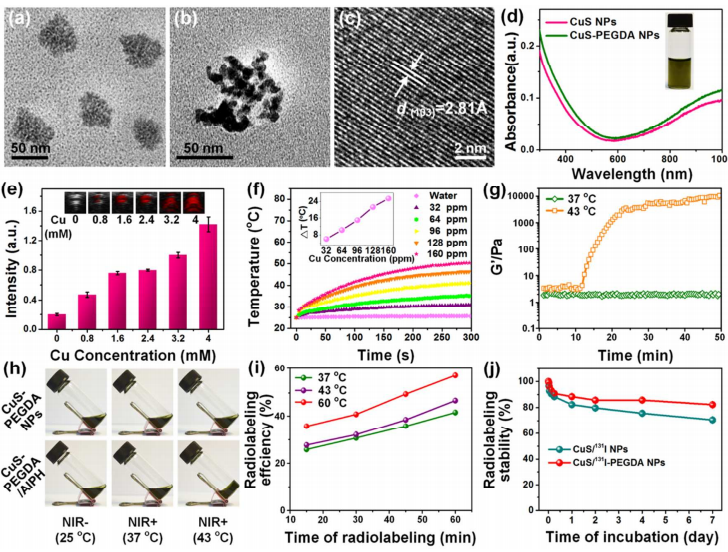
图2 CuS/131I-PEGDA水凝胶及其前体的制备表征
由于CuS-PEGDA在NIR区域的强烈吸收,研究人员对CuS-PEGDA的光声(PA)成像性能进行了评价。可以明显地发现PA信号强度会随着铜的浓度的增加而线性上升。随后对CuS-PEGDA NPs的光热转换性能进行了评估,结果显示CuS-PEGDA NPs的温度变化与浓度密切相关,并且在循环照射五次后仍然保持了良好的光热稳定性。
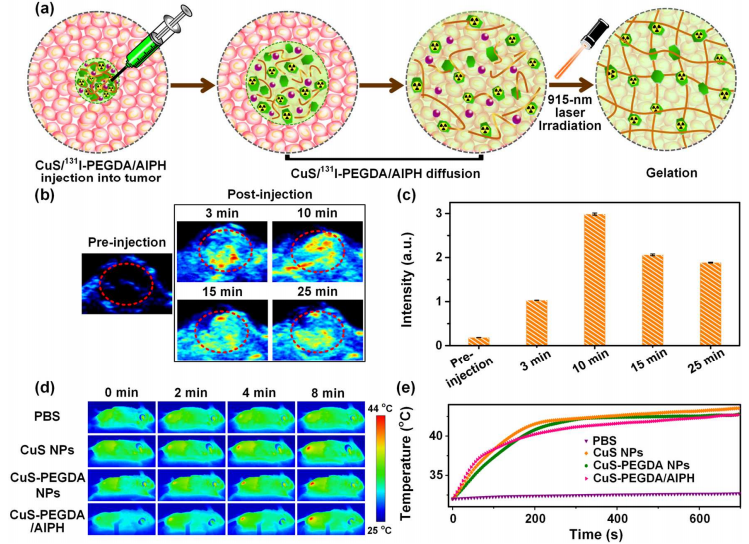
图3 活体成像及光热转化结果
CuS-PEGDA/AIPH溶液被注射到带有4T1肿瘤的Balb/c小鼠体内,PA成像数据显示,10分钟的时间内整个肿瘤中几乎是均匀分散的。随后肿瘤的PA信号显示轻微的下降,表明CuS NPs的可能通过淋巴引流泄漏到肿瘤周围组织。因此CuS-PEGDA NPs全肿瘤均匀分布以10分钟为最佳时机。利用红外(IR)热感摄像机来监控温度变化,发现在激光的照射下,注射CuS-PEGDA / AIPH发热肿瘤可以使得温度升高并保持在43度,而注射PBS的小鼠的温度变化则非常小。
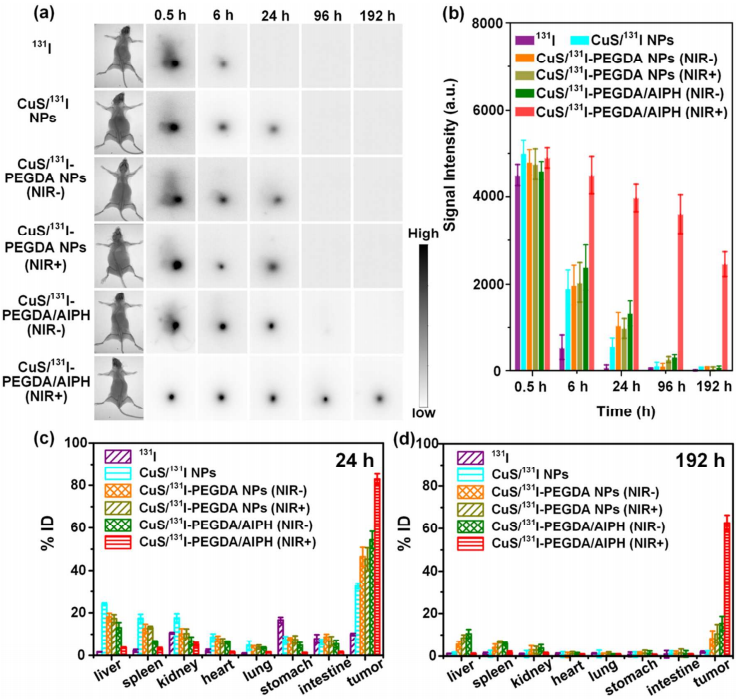
图4活体伽马射线成像及生物分布结果
生物分布结果实验证明,当向肿瘤注入131I NPs或CuS/131I-PEGDA NPs时,这些纳米颗粒将逐渐转移到其他器官,肿瘤的保留率很低。与之形成鲜明对比的是,对于注射了CuS/131I-PEGDA /AIPH并用激光照射的肿瘤,在其中发现了更高的放射性残留,并且很少转移到小鼠身体的其他部位。研究结果证实,近红外激光引发原位凝胶的CuS/131I-PEGDA /AIPH系统可以有效地保留CuS/ 131I纳米颗粒使得其在肿瘤内长期富集,有利于更有效稳定的肿瘤治疗。
利用免疫荧光染色使用检查肿瘤的缺氧状态实验表明,由于局部热疗效应促进肿瘤内血流,肿瘤缺氧信号在NIR触发光热后的最初几个小时内明显减弱。然而,缺氧状态也将在稍后逐渐恢复并在24后达到初始状态。因此反复地照射肿瘤是可以缓解缺氧来改善短距离放射治疗的。结果也发现每一轮的近红外激光辐照后,肿瘤治疗CuS-PEGDA / AIPH都大大削弱了肿瘤的缺氧信号。

图5 一次和多次治疗对于改善乏氧的对比
相对于对于只有一轮的NIR激光照射的肿瘤,重复的光热会导致长期的肿瘤缺氧缓解。基于PEGDA水凝胶对CuS/131I的长期肿瘤内保留的优良性能,以及利用NIR激光在该系统中触发重复光热和肿瘤缺氧缓解的特性,可采用一次注射但多次治疗的方法进行光热治疗。
活体治疗实验表明,仅依靠PTT治疗将无法有效地切除肿,因此相应地这些组的小鼠在治疗后仅有20-24天的寿命。同时,利用CuS/131I NPs或CuS/ 131I-PEGDA/AIPH进行单轮的近红外激光治疗,虽然显示肿瘤增长有被抑制,但在之后的效果也不明显。而在小鼠肿瘤内注射CuS/131I-PEGDA/AIPH和并且用三轮近红外激光照射后发现肿瘤迅速缩小,最终在第 10天消失。
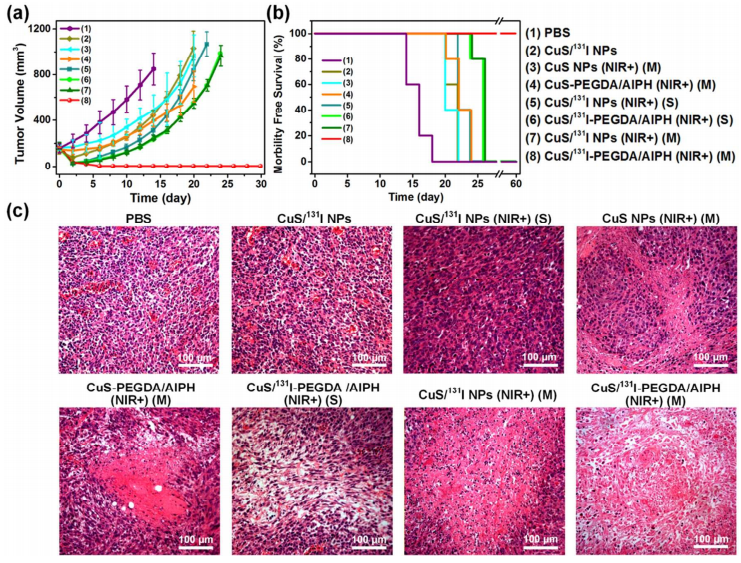
图6 活体肿瘤治疗效果
这一组的小鼠存活了超过60天,没有一个死亡,而所有其他对照组的小鼠在26天内相继死亡。这种显著的治疗效果的优势不仅要归功于NIR激光引发的原位胶凝形成所导致的CuS/131I长期在肿瘤内保留,而且还于多次触发的肿瘤缺氧缓解,以进一步提高放射性同位素131I对肿瘤细胞的破坏效力有关。
总之,这一工作开发出一种高效的NIR激活的混合水凝胶系统CuS/131I-PEGDA /AIPH,改善了短距离放射疗法的效果并减少了副作用,为推动这一疗法的应用提供了新的思路。
参考文献:
Meng Z, Chao Y, et al. Near-Infrared-Triggered in situ Gelation System for Repeatedly Enhanced Photothermal-Brachytherapy with a Single Dose[J]. ACS Nano, 2018.
DOI: 10.1021/acsnano.8b04544











