
纳米人编辑部对2018年国内外重要科研团队的代表性重要成果进行了梳理。今天,我们要介绍的是苏州大学先进生物材料与纳米医学实验室的刘庄教授课题组。
刘庄教授课题组近年来主要致力于生物材料与转化医学领域的研究,围绕肿瘤诊疗中的若干挑战性问题,发展了一系列新型纳米探针用于体外生物检测与活体分子影像,并探索了多种基于纳米技术和生物材料的肿瘤光学治疗、放射治疗、与免疫治疗新策略。
2018年,刘庄教授入选教育部“长江学者” 特聘教授,入选中组部万人计划 “领军人才”,入选 Periodic Table of YoungerChemists-IUPAC。除此之外,刘庄教授再一次入选科睿唯安(Clarivate Analytics)年度“高被引科学家”,入选学科横跨化学、材料科学、物理三大学科,这在整个入选名单中都属于凤毛麟角。
下面,我们简要介绍刘庄教授课题组2018年部分重要成果,供大家交流学习。
1)仅限于通讯作者文章,以online时间为准。
2)由于学术有限,所选文章及其表述如有不当,敬请批评指正。
1. 基于生物材料的放射免疫联合治疗新策略 | Nature Biomedical Engineering
在对抗癌症的这场持久战中,人们梦寐以求的是能有一种疗法既能清除原发性的肿瘤、又能抑制肿瘤转移甚至还能预防肿瘤的复发。然而,实现此功能并非易事。现如今,医院里治疗癌症的“三板斧”仍然是手术、化疗和放疗。
但是,肿瘤一旦发生转移,手术很难彻底清除转移后的肿瘤细胞,而局部放疗对于转移后的肿瘤通常也无能为力,化疗则有相当大的副作用且容易诱发细胞耐药。肿瘤免疫疗法是一种新兴的肿瘤治疗策略,近年来得到了国际上极高的关注。
有鉴于此,苏州大学刘庄教授团队和杨凯副教授团队合作,报道了一种基于生物材料的放射免疫联合治疗新策略。
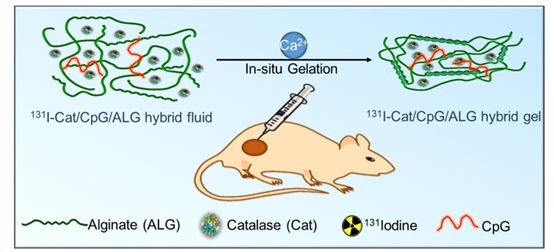
该研究将有治疗功能的放射性同位素碘131标记在过氧化氢酶上,然后将其与免疫佐剂CpG以及海藻酸钠均匀混合得到复合注射液。在这个体系中,过氧化氢酶可以高效地分解肿瘤组织间的内源性过氧化氢产生氧气,通过改善肿瘤乏氧以增强放疗疗效;CpG作为免疫佐剂,可以与内放疗摧毁肿瘤后其残留物中的肿瘤相关性抗原相互作用,产生肿瘤特异性的免疫反应;而海藻酸钠在局部注射到肿瘤内后,可以和肿瘤细胞间隙液中的钙离子结合快速形成凝胶,将碘131标记的过氧化氢酶固定在肿瘤内,从而增强其效果并且降低对正常器官的辐射副作用。
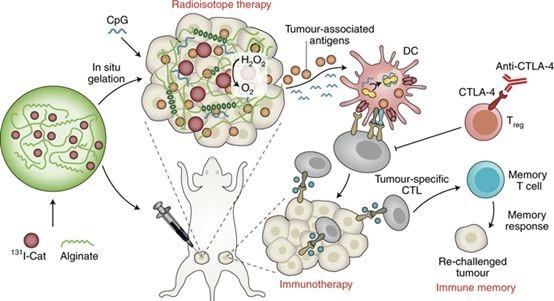
“将天然的生物材料作为纽带联合放射性同位素治疗和肿瘤免疫治疗,也许可以在摧毁可见实体肿瘤的同时消除转移的隐匿肿瘤病灶并且预防其复发。”刘庄教授如是说。
这种方法可以应用于肿瘤介入放射治疗来治疗多种类型的实体瘤,给那些处于发生肿瘤转移以及癌症中晚期且不能通过手术或者化疗治愈的患者或将带来新的机遇。值得一提的是,该策略中使用的所有的试剂都是基于天然生物材料,具有很好的生物相容性和临床转化前景。
Chao Y,Xu L, Liang C, et al. Combined local immunostimulatory radioisotopetherapy and systemic immune checkpoint blockade imparts potent antitumourresponses. Nature Biomedical Engineering 2018
DOI: 10.1038/s41551-018-0262-6
https://www.nature.com/articles/s41551-018-0262-6
2. 一次注射但多次治疗的肿瘤光热-短距离放射治疗 | ACS Nano
通过将治疗性放射性物质放入肿瘤或附近的区域中进行治疗的短距离放射治疗。在这一治疗方案中,生成的氧自由基被用于来攻击生物分子如DNA,然后杀死肿瘤细胞。然而,由于实体肿瘤微环境的缺氧性质,乏氧的肿瘤细胞比正常细胞更能抵抗辐射,从而导致了这一治疗方法对某些类型的癌症的治疗效果很差。此外,在一些临床病例中,局部植入放射源例如125I可能无法为整个肿瘤提供同质均匀的剂量分布,也会导致短距离放射治疗效果不佳。
有鉴于此,苏州大学刘庄教授课题组利用混合水凝胶体系,有效提高了CuS/131I的瘤内保留并多次持续改善瘤内乏氧来增强放射治疗效果。
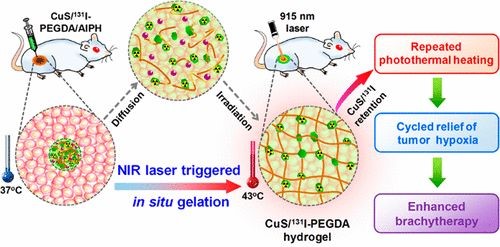
该课题组使用131I标硫化铜(CuS/131I)纳米粒子作为光热-放射疗法的试剂;聚乙二醇双丙烯酸酯(PEGDA)作为聚合物基体;AIPH作为热引发剂来实现光致原位凝胶光热-短距离放射联合治疗肿瘤。CuS/131I在915nm激光辐照下会产生热量适度地提高肿瘤温度,并通过激活AIPH热引发剂来启动PEGDA聚合,有效地通过原位凝胶化将CuS/131I固定在肿瘤内。通过对肿瘤的反复照射,缺氧可以得到长期有效的缓解,从而产生显著的协同光热效应消除肿瘤。
活体治疗实验表明,仅依靠PTT治疗将无法有效地切除肿,因此相应地这些组的小鼠在治疗后仅有20-24天的寿命。同时,利用CuS/131I NPs或CuS/ 131I-PEGDA/AIPH进行单轮的近红外激光治疗,虽然显示肿瘤增长有被抑制,但在之后的效果也不明显。而在小鼠肿瘤内注射CuS/131I-PEGDA/AIPH和并且用三轮近红外激光照射后发现肿瘤迅速缩小,最终在第 10天消失。
总之,这一工作开发出一种高效的NIR激活的混合水凝胶系统CuS/131I-PEGDA /AIPH,改善了短距离放射疗法的效果并减少了副作用,为推动这一疗法的应用提供了新的思路。
Meng Z, Chao Y, et al.Near-Infrared-Triggered in situ Gelation System for Repeatedly EnhancedPhotothermal-Brachytherapy with a Single Dose. ACS Nano 2018.
DOI: 10.1021/acsnano.8b04544
https://pubs.acs.org/doi/10.1021/acsnano.8b04544
3. 生物矿化中空纳米颗粒多模成像指导肿瘤光动力治疗丨JACS
纳米诊疗平台的开发可以同时改善诊断和治疗性能,同时减少副作用,对于精准癌症医学而言极具吸引力。2018年,刘庄、冯良珠团队及其合作者发展了一种生物矿化中空纳米颗粒多功能纳米诊疗平台。
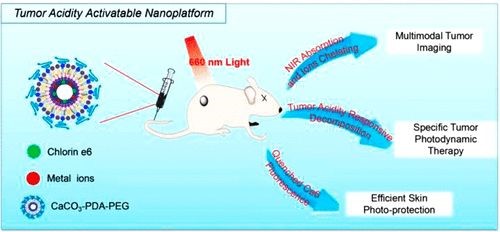
借助于气体扩散,研究团队发展了一种一步多巴胺介导的生物矿化方法,制备得到碳酸钙 - 聚多巴胺(CaCO3-PDA)复合空心纳米颗粒作为多功能治疗诊断纳米平台。由于这种纳米粒子对pH具有高灵敏度,可以在微酸性环境下快速降解,因此在pH值降低的情况下,负载的光敏剂(即由PDA淬灭的二氢卟吩e6(Ce6))的光活性在肿瘤内增加。表现出可恢复的荧光和更多的单线态氧生成。此外,由于金属离子与PDA之间的强亲和力,纳米粒子可以与各种类型的金属离子结合,赋予它们多模态成像能力。利用pH响应性多功能纳米载体,研究人员实现了在多模态成像的精确指导下实现有效的体内抗肿瘤光动力疗法(PDT)。有趣的是,在正常的生理pH下,这种纳米粒子被淬灭并且对正常组织显示出低得多的光毒性,因此有效地减少了PDT期间的皮肤损伤。总之,这项工作呈现了一种独特类型的生物矿化诊疗纳米颗粒,具有固有的生物相容性,多模式成像功能,高抗肿瘤PDT功效,并减少皮肤光毒性。
Ziliang Dong, LiangzhuFeng*, Zhuang Liu*. Synthesis of Hollow Biomineralized CaCO3–PolydopamineNanoparticles for Multimodal Imaging-Guided Cancer Photodynamic Therapy withReduced Skin Photosensitivity. J. Am. Chem. Soc., 2018, 140, 2165-2178.
4、Fenton催化剂和谷胱甘肽抑制剂增强肿瘤氧化应激用于增强化疗和放疗 | Nano Lett.
增强细胞内氧化应激是诱导癌细胞死亡的一种有效方法。2018年12月28日,刘庄教授团队及其合作者报道了一种Fenton催化剂和谷胱甘肽抑制剂增强肿瘤氧化应激用于增强化疗和放疗的新策略。
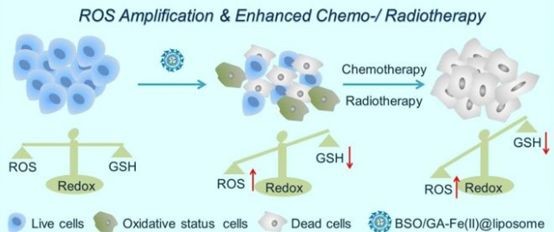
研究团队制备了一种独特的超小没食子酸-亚铁(GA-Fe(II))纳米配合物作为芬顿反应的催化剂,使H2O2能够持续转化为高细胞毒性的羟基自由基(•OH)。然后,GA-Fe(II)和l -丁硫氨酸磺磷(BSO)(谷胱甘肽(GSH)合成的抑制剂)被共同封装在一个脂质体纳米载体中来构建BSO/GA-Fe(II)@脂质体,它能够通过增加•OH的生成和减少GSH的生物合成来有效地增强细胞内氧化应激。与99mTc4+放射性同位素螯合后,BSO/GA-Fe(II)@ 脂质体可在单光子发射计算层析成像(SPECT)下进行体内成像跟踪。GA-Fe(II)介导的•OH生成和BSO介导的GSH耗损会显著增强肿瘤内氧化应激,从而显著提高化疗和放疗的效果。
Dong, Z.L., Feng, L.Z. et al.Amplification of Tumor Oxidative Stresses with Liposomal Fenton Catalyst andGlutathione Inhibitor for Enhanced Cancer Chemotherapy and Radiotherapy.NanoLetters 2018.
DOI:10.1021/acs.nanolett.8b03905
https://pubs.acs.org/doi/10.1021/acs.nanolett.8b03905
5. 双磷酸钙纳米材料用于增强放射性同位素治疗癌症 | ACS Nano
肿瘤相关巨噬细胞(TAMs)通常与放疗的预后不良有关。因此,降低TAMs浓度是提高放疗效果的一种很有前途的方法。2018年10月25日,刘庄和杨凯团队及其合作者介绍了一种生物相容性好的双磷酸钙基纳米材料(CaBP-PEG)用于非螯合的放射性同位素治疗(RIT),可以有效地减少TAMs的体内消耗,进行成像指导的增强的RIT。
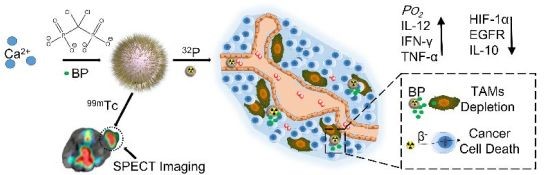
CaBP-PEG可以标记上各种放射性同位素,例如99mTc以及用于RIT的 32P。SPECT成像证明CaBP(99mTc)-PEG具有良好的肿瘤富集。同时CaBP-PEG也具有降低TAMs、抑制血管生成、肿瘤血管正常化、增强瘤内灌注和缓解肿瘤缺氧等作用。通过如此调节肿瘤微环境可以有利于RIT癌症,具有良好的临床应用前景。
Tian, L.L., Yi, X. et al.Calcium Bisphosphonates Nanoparticles with ChelatorFree Radiolabeling toDeplete Tumor-Associated Macrophages for Enhanced Cancer Radioisotope Therapy. ACS Nano 2018.
DOI: 10.1021/acsnano.8b06699
https://pubs.acs.org/doi/10.1021/acsnano.8b06699
6. 光动力免疫治疗癌症的智能纳米反应器| Nano Lett.
光动力疗法(PDT)是一种具有氧依赖性光触发的无创疗法,在癌症治疗中极具应用前景。对于有效的PDT,通常需要纳米级载体来实现光敏剂的肿瘤靶向递送。理想情况下,最好是能够靶向递送到最易受活性氧物质(ROS)影响的特定细胞器。其次,由于氧气对PDT诱导的癌症破坏至关重要,克服大多数实体瘤中存在的乏氧对于优化PDT功效至关重要。有鉴于此,刘庄团队及其合作者发展了一种具有光动力免疫治疗效果的智能纳米反应器。
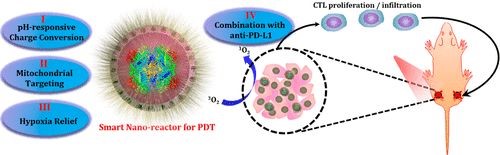
研究人员设计了一种独特的酶包裹的,合理表面工程设计的,光敏剂负载的中空二氧化硅纳米粒子作为智能纳米反应器。这种纳米颗粒表面对pH具有响应性,在酸性肿瘤微环境表现出增强的响应保留,并且能够进一步靶向线粒体,即对ROS最敏感的细胞器。同时,由纳米反应器引发的肿瘤内源性H2O2的分解将导致肿瘤乏氧情况大大减轻,有利于体内PDT。此外,通过将基于纳米颗粒的PDT与检查点阻断疗法相结合,可以实现全身性抗肿瘤免疫响应以杀死1-2 cm远的未经辐射的肿瘤,并有希望抑制肿瘤转移。
GuangbaoYang , Bin Li* , Zhuang Liu*. Smart Nanoreactors for pH-Responsive TumorHoming, Mitochondria-Targeting, and Enhanced Photodynamic-Immunotherapy ofCancer. Nano Lett., 2018, 18, 2475–2484.
除此之外,刘庄教授课题组2018年在生物材料和转化医学领域还发表了一系列重要成果,由于内容较多,在次不一一列出。感兴趣的读者可前往刘庄教授课题组网站学习:http://nano.suda.edu.cn/lz/
课题组简介:

刘庄,苏州大学教授,博士生导师 。2004年北京大学化学与分子工程学院获理学学士学位;2008年美国斯坦福大学(Stanford University)获得化学博士学位;2008年至2009年在斯坦福大学化学系以及医学院从事博士后研究。2009年6月加入苏州大学功能纳米与软物质研究院,被聘为教授,博士生导师。
刘庄教授课题组当前研究兴趣包括开发新型功能纳米材料,通过结构设计、可控合成、和合理的表面修饰得到功能丰富的生物相容性纳米材料,研究其在生命体系中的行为,并利用纳米材料独特的物理与化学性质以发展新型多模态生物影像技术、靶向药物输送技术、以及肿瘤物理治疗技术,从而探索癌症的诊断与治疗的新思路与新方法。











