第一作者:Wantong Song
通讯作者:陈学思
通讯单位:中科院长春应化所
核心内容:
1. 介绍了靶向模式识别受体(PRRs)来激活抗肿瘤免疫的基本概念。
2. 总结了基于生物材料的不同形式的PRRs激动剂在肿瘤免疫治疗中的最新进展。
固有免疫应答的优势
2018年,诺贝尔生理学或医学奖授予美国的詹姆斯•艾利森(James Allison)与日本的本庶佑(Tasuku Honjo),以表彰他们在癌症免疫疗法的贡献。近年来,肿瘤免疫治疗取得了巨大成功,包括anti-PD-1、anti-PD-L1和anti-CTLA-4在内的一大批免疫检查点抑制剂类药物被应用于临床。虽然这些以T细胞为基础的免疫疗法在多种肿瘤上被证明是一种有效的策略,但是其总体响应率很低。通过有效地激活肿瘤组织中的固有免疫应答,将“冷”肿瘤转变为“热”肿瘤,有望实现肿瘤从免疫不响应到免疫响应的转变。为此,近年来肿瘤免疫治疗的关注点逐渐向固有免疫方面转移。
介导固有免疫应答的方式——靶向模式识别受体
固有免疫是机体应对外来病原生物入侵的最初防卫手段,表达在固有免疫细胞表面或胞内的模式识别受体(pattern recognition receptors, PRRs)是介导固有免疫应答的重要分子。利用多种天然或合成的小分子、核酸或蛋白类免疫激动剂靶向PRRs能够有效激活固有免疫应答,并进一步促进抗肿瘤免疫响应。但是,PRR激动剂的使用必须谨慎控制,否则会出现致命的毒副作用。
内容简介
基于生物材料的纳米制剂、凝胶及可植入支架等能够通过缓控释方式显著降低PRR激动剂的毒副作用,同时增强PRR激动剂的免疫激活效果,为肿瘤免疫治疗提供了新的发展方向。有鉴于此,中科院长春应化所陈学思团队介绍了靶向PRRs来激活抗肿瘤免疫的基本概念,并总结了基于生物材料的不同形式的PRRs激动剂在肿瘤免疫治疗中的最新进展。
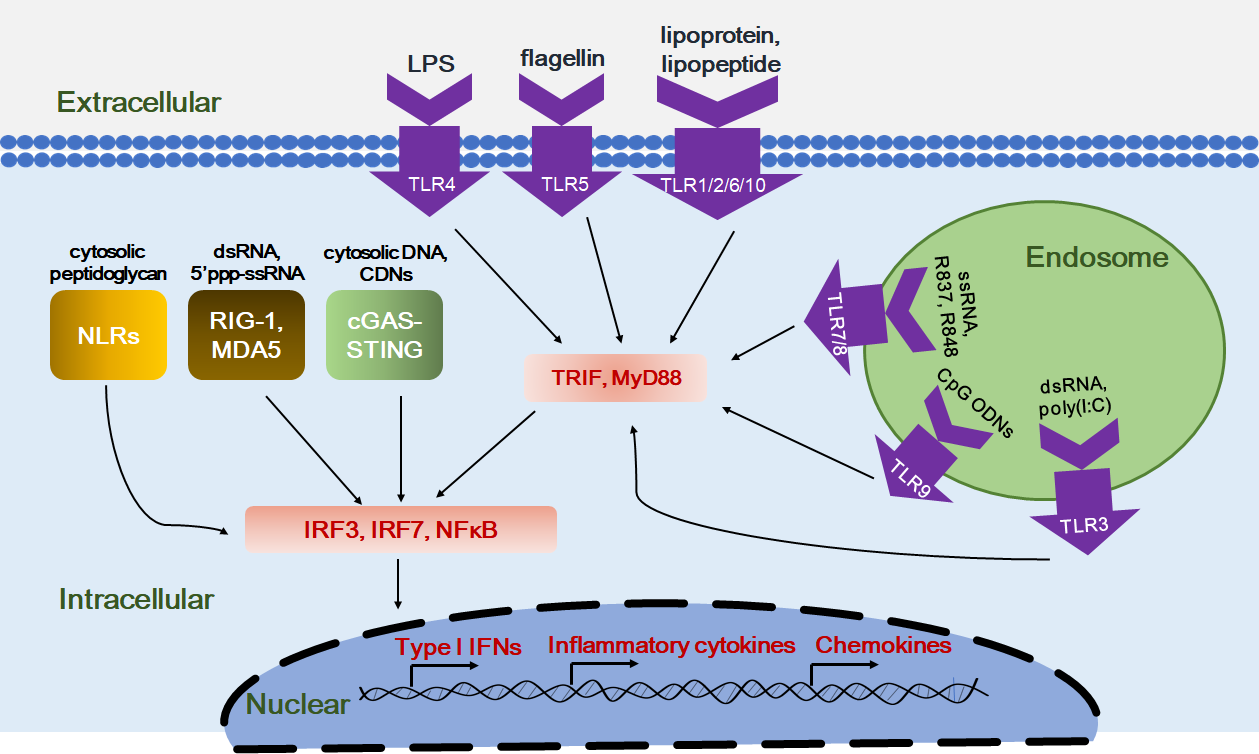
图1. 各种模式识别受体、激动剂及下游信号通路的总结 [1]
要点1:靶向模式识别受体来激活抗肿瘤免疫
模式识别受体在机体识别外来病原体和危险信号的过程中扮演了重要角色。PRRs包括多种受体家族,包括Toll样受体(Toll-like receptors,TLRs)、NOD样受体(NOD-like receptors,NLRs)、C型凝集素受体(C-typelectin receptors,CLRs)、RIG-I样受体(RIG-I-like receptors,RLRs)和细胞质DNA/RNA受体等。这些受体能够识别脂多糖(LPS)、脂蛋白、鞭毛蛋白以及一些特定的核苷酸序列。一旦模式识别受体受到上述物质刺激,就会启动炎症相关基因的表达,激活免疫系统以应对感染或组织损伤(图1)。
Toll样受体是表达在抗原提呈细胞的细胞膜或内涵体中的一类跨膜蛋白,能够识别来自病原微生物的相关抗原。Toll样受体包括从TLR1到TLR13的13种受体类型,其中TLR3、TLR7/8和TLR9在抗肿瘤研究中得到广泛关注,其相应的激动剂包括poly(I:C),R837/R848,CpG ODNs等已被用于联合肿瘤免疫治疗的尝试。
NOD样受体能够识别来自细胞间压力的危险信号,代表性的NOD样受体激动剂如Mifamurtide已被欧盟批准进行非转移性肉瘤的临床试验。
C型凝集素受体是一类跨膜蛋白受体,能够识别微生物膜表面的多种多糖,其激动剂如β-glucans作为辅助治疗在多种动物肿瘤模型上观察到有益效果。
RIG-I样受体与固有免疫系统识别病毒感染有关,其激动剂包括poly(I:C)等。
DNA通常位于细胞核内,当细胞质中出现DNA时会被认为是病原体入侵的危险信号,此时,细胞质内的DNA受体就会识别这些危险信号,启动进一步的免疫响应。基于此,以干扰素基因刺激蛋白(STING)为目标的免疫激动剂开发也成为当前肿瘤免疫治疗研发的热点。
要点2:以纳米材料为基础靶向模式识别受体
利用纳米技术递送PRR激动剂具有多种优势:纳米颗粒通过EPR效应可以促进PRR激动剂在肿瘤部位的富集;纳米载体能够防止不稳定的PRR激动剂降解并增加细胞对激动剂的摄取;适当粒径和表面特性的纳米颗粒能够进入肿瘤引流淋巴结并活化其中的DC细胞。
2.1 靶向TLR9的纳米激动剂
CpGODN是核酸类TLR9激动剂,其在血浆中易被降解且不易跨膜进入细胞,这些都极大地限制了其直接使用激活TLR9受体的效果。通过静电吸附或化学键合的方式,用纳米技术传输CpG成为近年来研究的热点。
本文总结了以下几种传输CpG的方式:(1)CpG与PEI通过静电作用制备纳米复合物;(2)利用基于PEG的纳米凝胶担载CpG;(3)以PLGA为载体传输CpG;(4)以金纳米颗粒为载体传输CpG;(5)以多孔材料为载体传输CpG;(6)以脂质体为载体传输CpG;(7)用化学修饰的方法键合小分子或蛋白提高CpG的传输效率。通过上述几种方式,有效提高了CpG的稳定性和细胞内吞,显著增强了CpG的免疫激活效果。
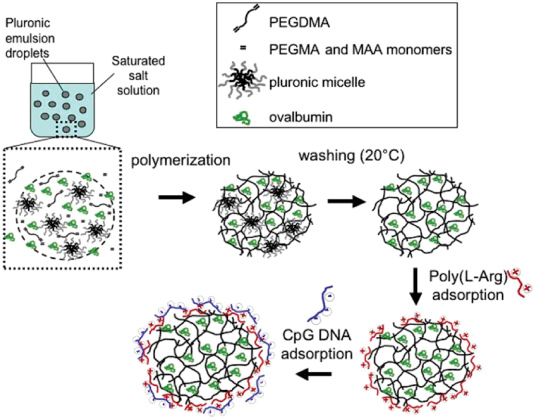
图2. PEG基纳米凝胶担载CpG [2]
2.2 靶向TLR7/8的纳米激动剂
以咪唑喹啉为基础的一类小分子能够作为TLR7/8的激动剂,但其同样面临毒副作用大等问题。通过以下传输手段增强了TLR7/8小分子激动剂的作用效果同时减小了其毒副作用:(1)以化学改性的多糖,通过物理包埋或超分子作用担载R837/R848;(2)以PLGA为载体担载R848;(3)以金纳米颗粒为载体担载R848;(4)将TLR7/8激动剂键合到高分子载体上来进行传输;(5)将TLR7/8激动剂键合到蛋白进行传输。
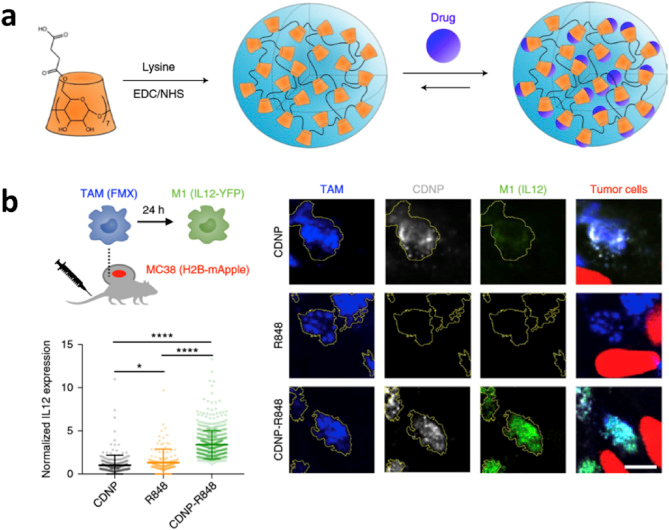
图3. 设计β-环糊精纳米颗粒,用于R848递送以及肿瘤相关巨噬细胞“再教育” [3]
2.3 靶向STING的纳米激动剂
STING通路的受体位于细胞质内,因此要实现有效的STING通路的激活,需要将激动剂传送到细胞质中去。本文总结了STING激动剂通过以下几种方式进行递送:(1)以脂质体为载体递送;(2)以改性葡聚糖,PEI静电复合物等为载体递送。
这些递送方式都有效防止了STING激动剂的降解。例如,阳离子脂质体担载的STING激动剂cGAMP,有效增加了cGAMP进入细胞的效率,同时,由于STING通路的受体位于细胞质中,阳离子载体在被细胞内吞后能够有效促进cGAMP向细胞质中的释放,更好地促进了STING通路的激活。除此之外,有些合成材料本身被证明能够促进STING通路的激活,例如Luo等人合成的阳离子聚合物材料可以直接激活STING通路发挥抗肿瘤作用。
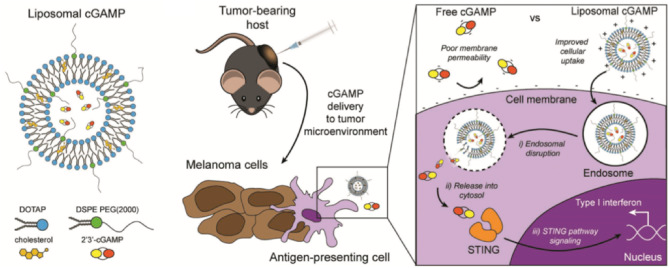
图4. 脂质体担载的cGAMP的结构以及作用机理 [4]
2.4 靶向其它PRR的纳米激动剂
除上述几种常见的PRR靶点外,还有针对其它PRR受体的纳米激动剂被开发出来。例如,Das等人以磷酸钙纳米粒传输RLRs的激动剂pppRNA,在静脉注射时,单独使用上述纳米制剂可以有效抑制胰腺癌肿瘤的生长,而裸露的pppRNA则完全没有肿瘤抑制效果。另外,多种PRR激动剂联合使用也是有效激活免疫响应的一种方式,Sun等将Pam3CSK4, MPLA和R837等激动剂共载,更好的发挥了免疫激活的效果。
要点3:利用生物材料局部缓释模式识别受体激动剂
生物可降解高分子材料被广泛用于制备凝胶和支架,这些凝胶和支架作为局部药物缓释载体能够实现药物的长效释放并有效降低系统毒性。常用的生物可降解高分子材料如PCL、葡聚糖、PEG等,都可以通过改性的方式制备支架担载免疫激动剂和免疫检查点药物,并被证明能够有效地发挥抗肿瘤或防止肿瘤复发的作用。
基于DNA的凝胶体系越来越多地被用于免疫治疗领域。DNA与阳离子多糖混合制备的凝胶体系担载CpG,有效防止了CpG在肿瘤内的降解,并显著增强了CpG的抗肿瘤效果。
模拟病原体感染招募免疫细胞的方式,也能够有效激活免疫。通过将肿瘤抗原、TLR激动剂和趋化因子共载入多孔硅支架,能够有效招募DC细胞进入支架摄取肿瘤抗原,取得了显著的抗肿瘤效果。
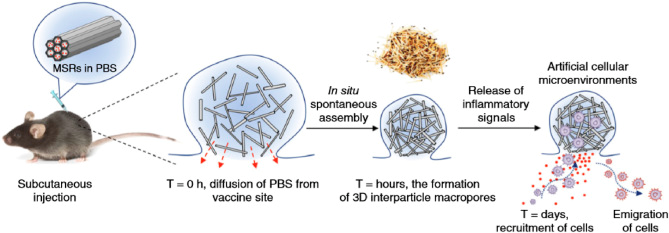
图5. 通过体内自发组装形成的多孔硅支架用于细胞招募 [5]
总结与展望
由于肿瘤的免疫抑制微环境,导致肿瘤中的新生抗原无法被免疫细胞识别。通过外源介入的方法可以激活肿瘤的免疫微环境从而产生有效的抗肿瘤效果。PRR激动剂虽然已经被广泛应用于肿瘤疫苗的研究,但仍面临易降解,毒副作用大等问题。基于生物材料的靶向递送技术无疑为PRR激动剂的抗肿瘤治疗增添了强大动力。
未来,基于生物材料的PRR激动剂仍有许多值得思考的问题,首先,深入发掘基于生物材料的PRR激动剂的作用机制,探索更有效的给药方式,有望开发出更有效的肿瘤免疫治疗制剂;其次,针对免疫激活过程的需求,设计智能响应性生物材料来进一步发挥PRR激动剂的效果,都是值得进一步探索的方向。
参考文献:
SongW, Das M, Xu Y, Si X, Zhang Y, Tang Z, Chen X. Leveraging Biomaterials forCancer Immunotherapy: Targeting Pattern Recognition Receptors. Materials TodayNano, 2019.
DOI:10.1016/j.mtnano.2019.100029
https://www.sciencedirect.com/science/article/pii/S2588842019300082?via%3Dihub
参考文献:
[1]SongW, Das M, Xu Y, Si X, ZhangY, Tang Z, Chen X. Leveraging Biomaterials forCancer Immunotherapy: TargetingPattern Recognition Receptors. MaterialsToday Nano, 2019, 5, 100029.
[2] Jain, S.; Yap, W.T.; Irvine, D. J. Synthesis of protein-loaded hydrogel particles in an aqueoustwo-phase system for coincident antigen and CpG oligonucleotide delivery toantigen-presenting cells. Biomacromolecules2005, 6, 2590-600.
[3] Rodell, C. B.; Arlauckas, S. P.; Cuccarese,M. F.; Garris, C. S.; Li, R.; Ahmed, M. S.; Kohler, R. H.; Pittet, M. J.;Weissleder, R. TLR7/8-agonist-loaded nanoparticles promote the polarization oftumour-associated macrophages to enhance cancer immunotherapy. Nature Biomedical Engineering 2018, 2,578-588.
[4] Koshy, S. T.; Cheung, A.S.; Gu, L.; Graveline, A. R.; Mooney, D. J. Liposomal Delivery Enhances ImmuneActivation by STING Agonists for Cancer Immunotherapy. Advanced Biosystems 2017, 1, 1600013.
[5]Kim, J.; Li, W. A.; Choi, Y.; Lewin, S. A.;Verbeke, C. S.; Dranoff, G.; Mooney, D. J. Injectable, spontaneouslyassembling, inorganic scaffolds modulate immune cells in vivo and increasevaccine efficacy. Nature biotechnology 2015,33, 64-U241.
更多肿瘤免疫技术前沿进展,请进入纳米人官网查看:
www.nanoer.net