
第一作者:陈文
通讯作者:郭俊凌、James Chou
通讯单位:四川大学、哈佛大学
研究亮点:
发展了一种膜蛋白呈递技术——以植物多酚修饰的纳米颗粒为内核,通过纳米颗粒和膜蛋白的特异结合作用,将膜蛋白脂质体高效地包裹在纳米颗粒表面形成类病毒结构。
膜蛋白呈递研究难点
目前在研发的抗体药物,大部分都是以生物膜蛋白以及膜锚定蛋白为靶点。但是,把这些生物膜蛋白质呈递给免疫系统是当前的核心难点,特别是大部分关键的膜蛋白需要在有膜或者类膜的环境下才能保持正常的构象及生物学功能。
现在主要有以下三种方法来呈递膜蛋白:1. 将膜蛋白放入脂质体中;但是脂质体本身并不稳定,并且容易和细胞内的囊泡相融合;同时,在把膜蛋白质重组到脂质体的过程中,膜蛋白的朝向完全是随机的;2. 纳米碟也被广泛的用作膜蛋白的载体,并且非常稳定;但是纳米碟尺寸较小(15纳米以内),一个纳米碟只携带1-2个膜蛋白,对于免疫系统的刺激作用很弱;3. 利用类病毒颗粒来呈递;类病毒颗粒的制作程序对于每个膜蛋白都不一样,每个系统都要花费很多的时间和材料来优化,而且很多过程难以人为控制。
成果介绍
为了解决膜蛋白的呈递问题,四川大学郭俊凌与哈佛医学院James Chou、陈文联合团队以植物多酚修饰的纳米颗粒为内核,通过纳米颗粒和膜蛋白的特异结核作用,将膜蛋白脂质体包裹在纳米颗粒表面。此方法被命名为SPLANDID (Supported ProteoLiposomefor ANtigen DIrected Display)。通过此方法,他们成功的将艾滋病病毒的跨膜蛋白和膜外临近区(HIV-1 MPER-TMD)重组在加固的脂质体表面并进行了免疫实验。
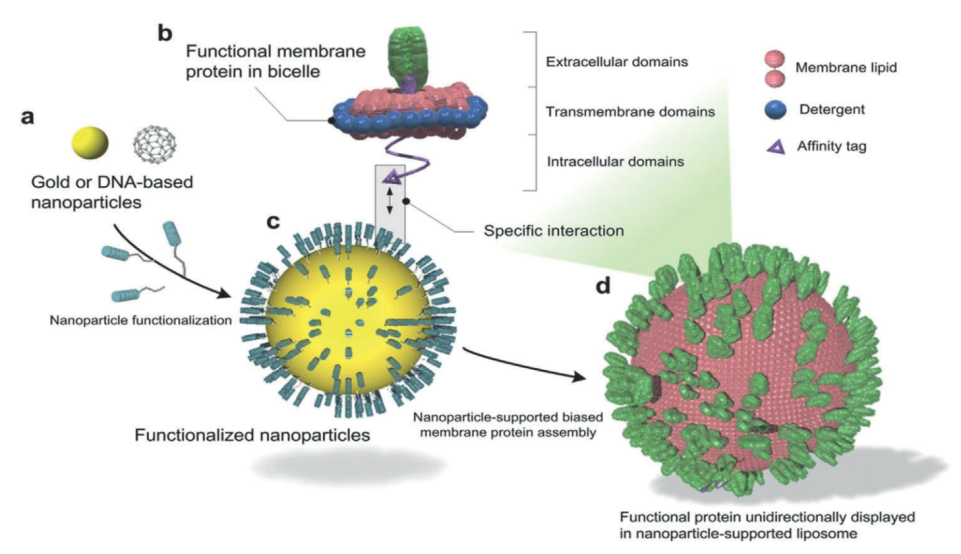
图1. 纳米颗粒支撑的蛋白质脂质体用于膜蛋白单向陈列。
SPLANDID方法的具体流程如图一所示:1a. 空心和实心的纳米颗粒都可以用来作为内核(包括植物多酚修饰的颗粒,以及DNA折纸法制备的DNA空心球);1b. 纯化后的膜蛋白质被重组在脂碟(bicelle)中(脂碟包含脂成分和表面活性剂来模拟膜环境);1c. 将纳米颗粒的表面修饰上某些化学基团,使之可以和膜蛋白质上的亲和标签特异性的结合(包括Ni-NTA分子和组氨酸标签的结合); 1d. 膜蛋白质携带脂碟被有序的吸引到纳米颗粒的表面,通过透析作用或者其他方法逐渐的将表面活性剂去掉,脂分子会相互融合,进而形成封闭的包含有膜蛋白质的脂质体。因为膜蛋白是通过亲和标签吸附到纳米颗粒的表面,所以带有亲和标签的一端会朝向纳米颗粒,并最终被包裹在脂质体内部;而另外一端会暴露在脂质体的表面。这样组装的脂质体就携带有序单一朝向的,并且高拷贝数,具有活性的膜蛋白质。
该研究首先制备了植物多酚修饰的金纳米颗粒,并将NTA分子与多酚苯环上产生亲核反应,并加入镍离子,从而在金纳米颗粒表面形成Ni-NTA配合物(图二a)。修饰后的纳米颗粒和组氨酸标签的亲和作用通过核磁共振谱进一步验证(图二b)。将重组在脂碟中的HIV-1 MPER-TMD和修饰后的金多酚纳米颗粒以最佳比例混合,并通过透析去掉系统中的表面活性剂,最终得到了由膜蛋白和纳米颗粒诱导形成的大小均一的膜蛋白脂质体(图二d,e)。在HIV-1 MPER-TMD的N端和C端分别有抗Flag标签和组氨酸标签,最终制备的HIV-1 MPER-TMD脂质体只能被抗组氨酸标签的抗体识别,而不能被抗Flag的抗体识别(图二g),说明了HIV-1 MPER-TMD在脂质体的朝向是单一的,能被精确控制的。同时,该研究也测试了利用DNA折纸法形成的空心球作为内核也同样能指引HIV-1 MPER-TMD脂质体的组装(图二f)。
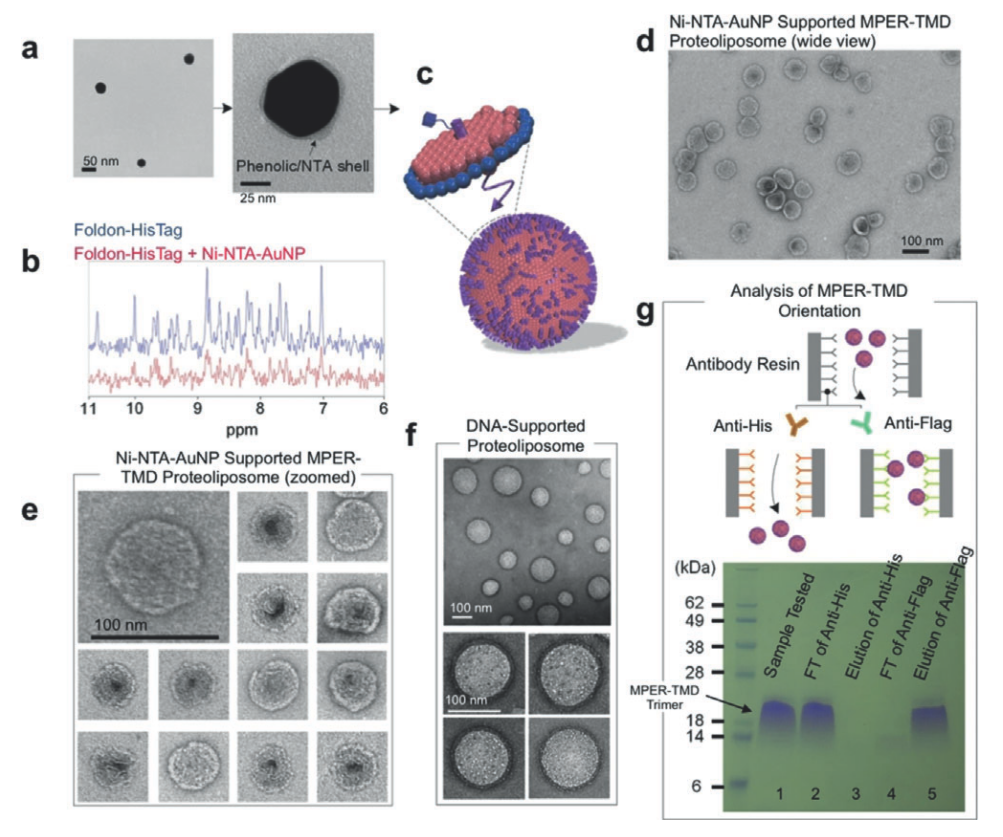
图2. 采用重组MPER-TMD制备纳米颗粒支撑的膜蛋白脂质体。
通过SPLANDID方法制备的MPER-TMD脂质体能够高效的刺激免疫系统产生特异性抗体。将组装好的MPER-TMD脂质体注射到豚鼠的体内,并在每次注射后的4个星期收集豚鼠的血清(免疫实验仍在进行中)。通过ELISA反应的检测,血清里含有大量可以和MPER-TMD蛋白特异性结合的抗体,并且抗体的含量随着免疫实验的进行而增加(图三)。MPER-TMD蛋白由于大部分区域都在生物膜内,具有非常弱的免疫原性,到目前为止还没有通过免疫MPER-TMD蛋白而诱导产生中和性抗体的记录。但是,通过SPLANDID方法制备的MPER-TMD脂质体,可以在很短的时间内就能通过免疫反应在动物体内产生的大量的抗体,为鉴定艾滋病的中和性抗体打下了良好的基础。
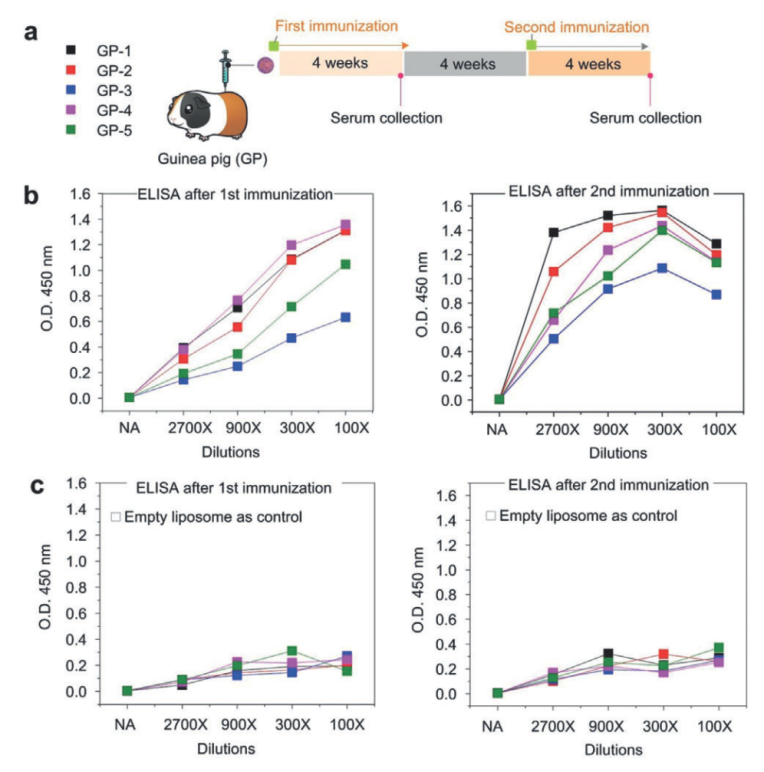
图3. Ni-NTA-AuNP支撑的MPER-TMD膜蛋白脂质体的免疫原性。
小结
由于该技术的重要应用前景,该研究团队已提交美国及中国专利。由SPLANDID方法制备的生物膜蛋白脂质体,具有以下的优点:1. 高效组装成均一的脂质体;2. 蛋白质的单一朝向;3. 每个脂质体能携带众多数量膜蛋白质;4. 完全的模拟生物膜环境,能还原膜蛋白质的功能;5. 由于纳米颗粒作为内核,脂质体非常稳定;6. 脂质体的大小可以精确控制。所以的这些优点保证了SPLANDID方法可以用来制备以膜蛋白为基础的新型疫苗,同时也可以用来研发各种受体蛋白、离子通道以及转运蛋白的高效抗体。
参考文献:
Chen W, Cai Y, Fu Q, Chen B, Guo J* and ChouJ J.* Unidirectional Presentation of Membrane Proteins in Nanoparticle‐Supported Liposomes. Angewandte Chemie International Edition,2019.
DOI: 10.1002/anie.201903093
https://onlinelibrary.wiley.com/doi/10.1002/anie.201903093
作者简介:
1. 郭俊凌
墨尔本大学化学与分子生物学博士,中央组织部“国家特聘计划”青年项目获得者,四川大学“双百人才”海外高层次引进特聘教授,博士生导师(2019年入职),曾任职于美国哈佛大学Wyss仿生工程研究中心特聘研究员(研究主页:https://scholar.harvard.edu/junlingguo)。于墨尔本大学国际著名材料化学家Frank Caruso教授(英国皇家科学院院士,澳大利亚科学院、工程院双院院士)课题组获博士学位。哈佛大学期间于Samir Mitragotri教授(美国工程院、美国医学院双院院士)课题组、Neel Joshi教授(Wyss仿生工程研究中心委员会委员)课题组、Daniel Nocera教授(美国科学院、美国艺术与科学院双院院士)课题组开展合作研究。曾师从中国工程院石碧院士、国务院学位委员学科评议组廖学品教授。2019年依托于四川大学制革清洁技术国家工程实验室,国家“双一流”重点建设学科,建立生物质先进材料与纳米界面研究中心(BMNI),与石碧院士课题组开展学生联合培养及交叉学科研究。
课题组研究方向将主要涉及“金属多酚网络”MPN先进材料的研究与工程应用、生物质仿生材料设计及研究、生物质界面前沿科学的研究和应用开发,致力于先进环境工程、新能源开发、细胞生物工程等前沿领域的基础及工程研究。近年来,相关研究以第一或通讯作者在《Science》《Nature Nanotechnology》《Energy & Environmental Sciences》《Angewandte Chemie》等国际顶级期刊上发表,共发表高质量学术论文约50篇,顶级期刊封面8篇,并被多家国际著名新闻媒体报道,包括F1000评为领域重大研究、EurekAlert!、Harvard Gazette、ChemViews Magazine、Phy.org、德国之音等,并被《Nature Nanotechnology》、《Nature Biotechnology》、《Nano Today》等学科顶级杂志选为特别专题与研究热点。
团队招聘:
生物质先进材料与纳米界面研究中心(BMNI)现招聘范围涉及多个联合跨学科研究项目,计划招纳各领域贤才多名(不限背景),包括专职博士后(四川大学专业技术职务晋升通道)、博士、硕士研究生(国际顶尖机构联合培养计划)、课题组行政助理等;特别优秀的海外博士学位获得者,可协助申请四川大学特聘副研究员岗位,欢迎前来咨询交流。相关政策详情参见四川大学人事处网站:http://rsc.scu.edu.cn/info/1023/1015.htm。有意应聘者请将个人简历和工作总结发至junling.guo@scu.edu.cn。
2. 陈文
美国伦斯勒理工学院博士,曾担任汉密尔顿学院特聘科学家,现任哈佛医学院博士后,多年来一直从事与蛋白质、核酸等生物大分子以及纳米颗粒等领域相关的研究工作,所作研究工作涉及有生物酶工程筛选进化、多功能纳米颗粒的制备、生物膜蛋白等大分子高分辨率结构的解析与模拟、生物大分子以及小分子的鉴定、营养食品对慢性病的缓解、同时包括核磁共振及质谱等其他生物物理、生物化学方法的新应用。近年来,在《Nature》、《Cell》、《AngewandteChemie》、《Nature Protocols》、《Nature Communications》、《JACS》等学科顶级期刊发表论文20余篇,并多次获得美国垦务局、美国农业部以及中华海外磁共振协会创新大奖。
3. James Chou周界文
哈佛大学医学院终身教授,主要研究方向为蛋白质的结构与功能,利用核磁共振和其他生物物理方法分析膜蛋白结构与动态特性,理解功能与机制。在Nature, Cell, Science, NSMB, PNAS, JACS等国际顶尖期刊共发表SCI论文90多篇,总引用次数超7500次。
在离子通道方面,测定的流感病毒AM2和BM2质子通道的结构,是世界上最早的病毒质子通道的高分辨率结构(Nature,2008; Nature Struct & Mol Biology,2009),并通过对质子通道结构的深刻理解,用实验证明了AM2与金刚烷胺药物结合的原理,解释了甲型流感病毒对金刚烷胺的耐药机制(PNAS 2009;JACS 2011;Structure2011);后来又解析了丙肝病毒的p7阳离子通道的结构和其与药物的结合机制 (Nature 2013),线粒体钙离子通道MCU和其与抑制剂Ru360的结合机制 (Nature 2016; PNAS 2017)。
在免疫研究方面,阐明了免疫受体复合体在细胞膜里的装配原理和信号传递机制(Cell 2006, 2008;Nat Immunol 2010;Mol Cell 2016),对免疫学中跨膜信号传递的分子机制的理解起到了巨大的作用;研发了一种新的基于残余偶极耦合(RDC)实验的分子片段重排(MFR)方法,测定了线粒体非偶联膜蛋白质(UCP2)的结构(Nature 2011);使用核磁动力学方法观察到膜转运蛋白在非晶体状况下的动态特性及构相变化 (NSMB 2015)。使用新的bicelle技术解析HIV病毒膜融合蛋白跨膜部分的结构 (Science 2016)。近期发现了TNFR家族蛋白的受体激活新机制(Cell, 2019)。











