酶能够有效催化复杂自然网络中维持生命的生物转化,其效率,特异性和选择性远远超过人工催化剂。但是酶固有的脆弱性,例如极易受温度和pH波动的影响,以及对大多数有机溶剂和小分子抑制剂的低耐受性等,大大限制了酶在实际操作中的有效性。将酶嵌入金属有机框架(MOFs)的外骨架中(enzyme@MOFs)可以改善酶固有的脆弱性。它不仅可以延长酶的寿命,而且可以赋予MOsF新的生物功能。尽管嵌入MOFs的酶的稳定性显著提高,但是,人们对酶嵌入MOFs的嵌入方式和酶生物功能的转化的研究却甚少。近日,中山大学Gangfeng Ouyang等首次揭示了嵌入方式如何影响封装在ZIF-8中的酶的生物活性。研究发现,如果酶@MOFs的嵌入过程是由快速的酶触发的ZIF-8成核作用驱动的,可以保持与游离酶相当的高酶活性;然而,如果是慢速共沉淀过程驱动嵌入的情况下,其中的酶不参与ZIF-8的成核,由于配体(2-甲基咪唑)的解折叠作用和竞争性配位作用,获得的酶@MOFs趋于失活。更重要的是,这两种不同的嵌入模式可以容易的通过对酶氨基酸的化学修饰来控制,从而调节被包封的酶的生物功能。
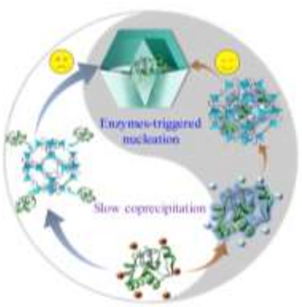
Guosheng Chen, Gangfeng Ouyang*, et al. Modulating the Biofunctionality of Metal‐Organic Framework‐Encapsulated Enzymes through Controllable Embedding Patterns. Angew. Chem. Int. Ed., 2019
DOI: 10.1002/anie.201913231


















