将抗癌药物以高精度和高效率传递至靶细胞至关重要。尽管已经证明纳米材料一旦达到靶点就可以提高传递效率,但是精确的药物传递克服非特异性吸附和脱靶效应仍然是挑战。为了应对这一挑战,于此,福州大学吴再生教授和美国伊利诺伊大学陆艺教授等人报道了一种新型DNA纳米结构的设计,该结构可作为DNA纳米级精确制导导弹(D-PGM)用于高效加载化学治疗剂并将其精确递送至特定靶细胞。D-PGM由两部分组成:弹头(WH)和制导/控制(GC)。WH是棒状DNA纳米结构,作为药物载体,其主干是由x-y维两个回文DNA序列和z向两个常见DNA寡核苷酸的程序杂交形成的三维自组装DNA纳米结构,使WH具有较高的药物有效负载能力。GC是一种基于适体的逻辑门,以高度有序的方式组装,能够通过由细胞锚定的适体介导的顺序拆卸来执行细胞亚型特异性识别。由于WH和GC之间的协同作用,GC逻辑门的操作类似于精密制导导弹中的制导和控制系统,将载有阿霉素(DOX)的DNA WH引向目标癌细胞,从而导致选择性和增强治疗功效。此外,接在D-PGM和DOX不同位置的荧光团在释放时产生荧光,使DNA纳米结构和药物的细胞内追踪成为可能。结果表明,通过模仿军用精确制导导弹的功能来设计多刺激响应方式的GC系统顺序拆卸,固有的生物相容性和可降解D-PGM可以准确地识别复杂生物环境中的目标癌细胞并实现主动靶向药物递送。该策略的成功为特异性细胞识别和靶向癌症治疗铺平了道路。
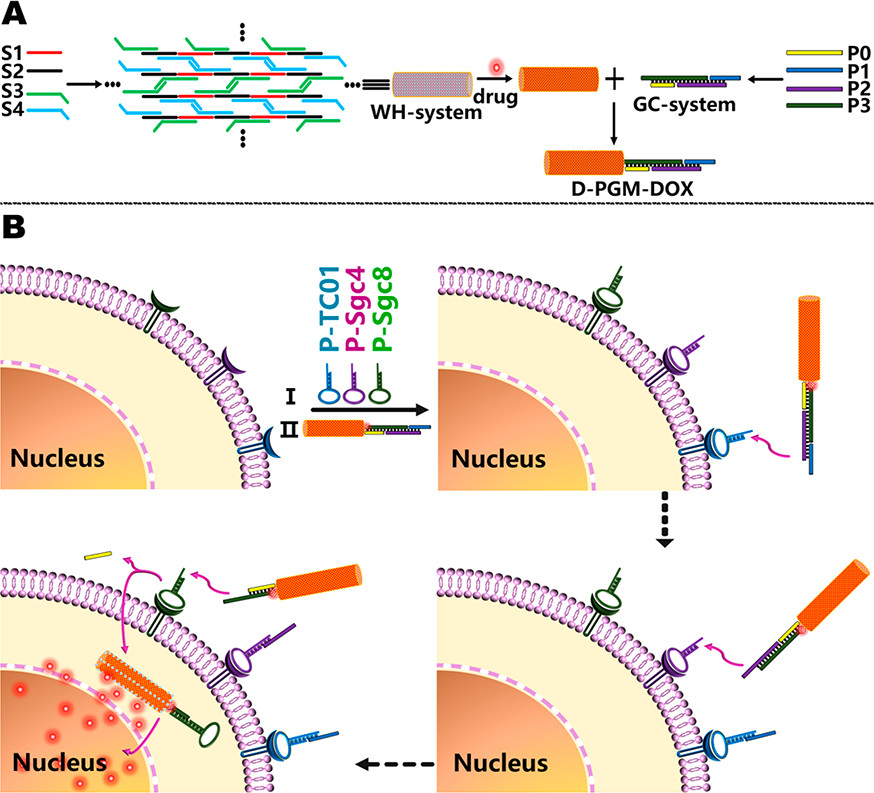
Changhe Ouyang, Songbai Zhang, Chang Xue, Xin Yu, Huo Xu, Zhenmeng Wang, Yi Lu, and Zai-Sheng Wu. Precision-Guided Missile-Like DNA Nanostructure Containing Warhead and Guidance Control for Aptamer-Based Targeted Drug Delivery into Cancer Cells in Vitro and in Vivo. Journal of the American Chemical Society 2020.
DOI: 10.1021/jacs.9b09782
https://doi.org/10.1021/jacs.9b09782


















