细菌感染对人类健康构成严重威胁。光动力疗法是解决耐药细菌问题的有效手段。但是要有能同时产生高效荧光和活性氧的光敏剂(PSs)并非易事。传统的PSS在水介质中由于聚集猝灭效应而表现出折衷的性能,而具有聚集诱导发射(AIE)的发光体可以固有地实现高荧光和高效的ROS产生。另外,静电相互作用通常被认为是引起细菌初始靶向的原因。但对于AIE PSs,很少考虑分子内电荷对抗菌效果的影响。
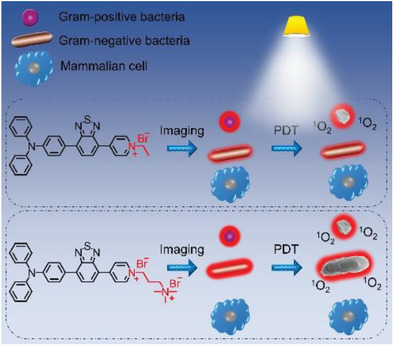
有鉴于此,深圳大学李莹,香港科技大学,深圳大学唐本忠院士,Ryan T. K. Kwok等人设计了两种带不同正电荷数、发光核相同的AIE型红色发光PSs,研究了它们对革兰氏阳性菌(G(+))和革兰氏阴性菌(G(−))的抗菌性能和杀菌机理。
文章要点:
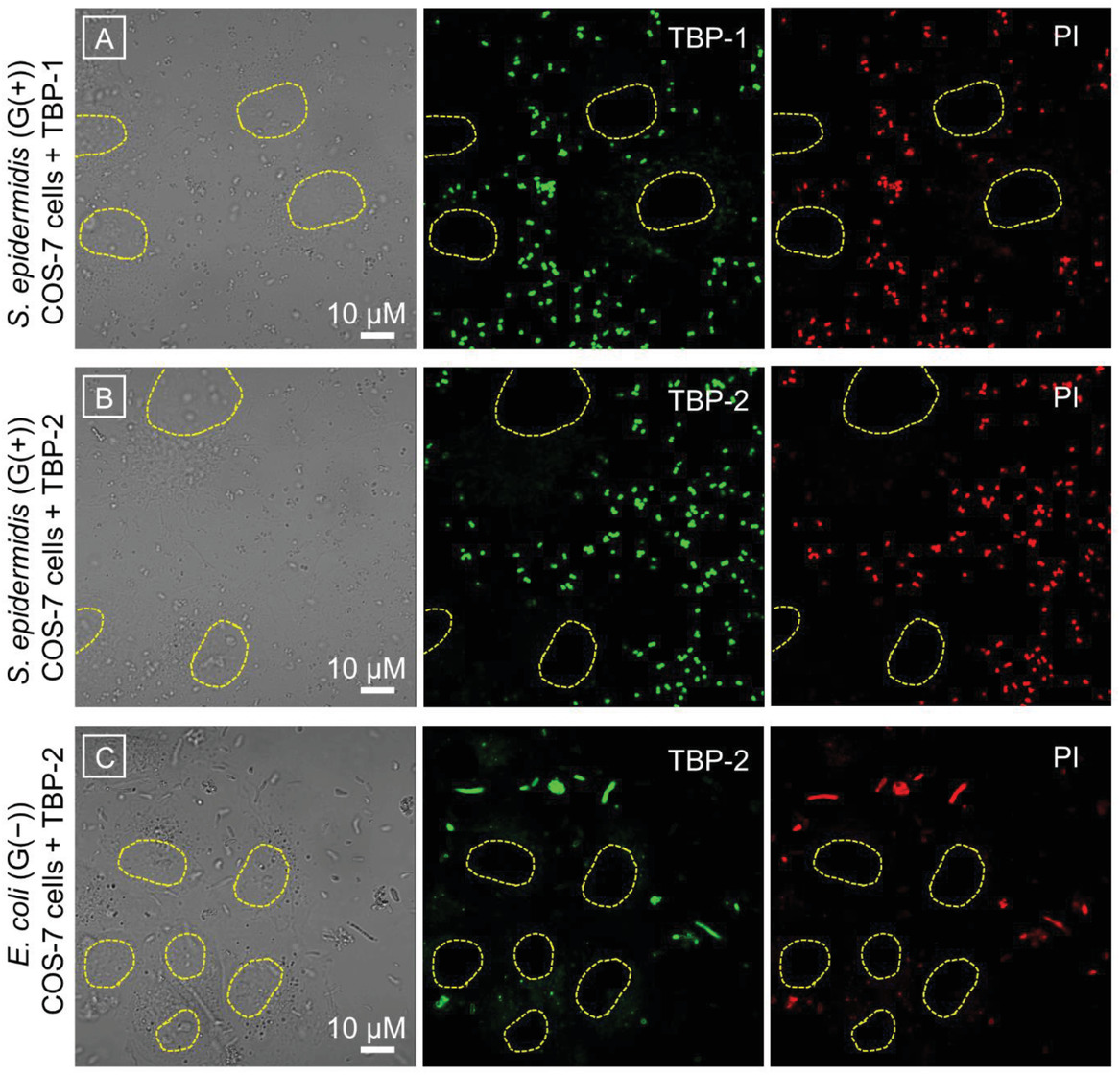
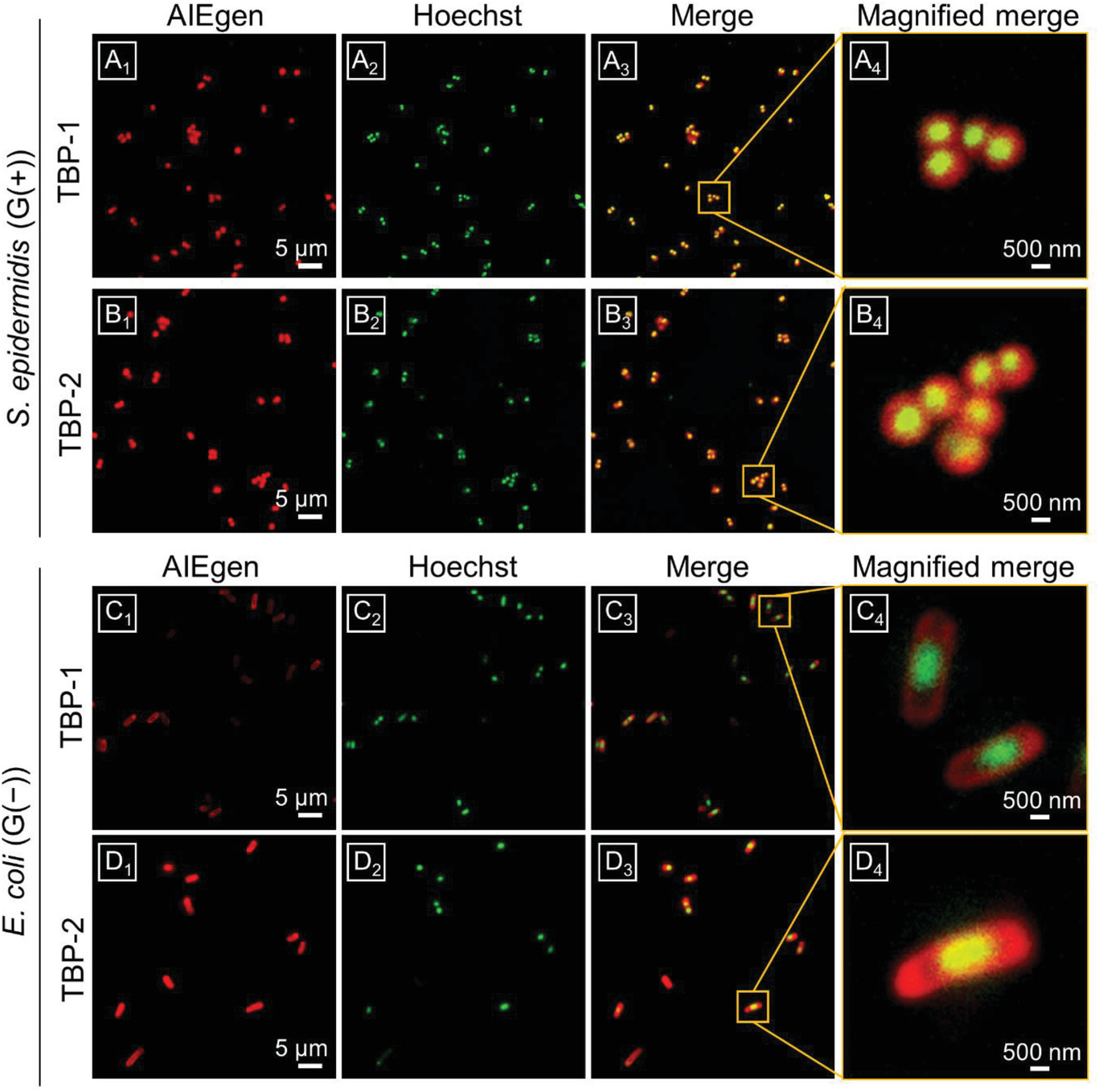
1)研制了两种具有优良单线态氧产生性能的AIE红光PSs。由于正电荷数在结构上略有不同,两种AIE PSs在细菌光灭活中表现出不同的行为。阳离子AIEPSs均能在黑暗中染色和灭杀G(+)菌(表皮葡萄球菌和金黄色葡萄球菌),且在超低白光剂量(4.2mW/cm-2)作用10min后,其抗菌效果进一步增强。相反,由于细菌外膜的保护,它们对G(−)菌(大肠杆菌和大肠杆菌TOP10(耐药菌))无暗毒性。在超低白光剂量下(4.2mW/cm-2)作用30min后,TBP-2对G(−)菌(大肠杆菌和大肠杆菌TOP10(耐药菌))表现出有效的光毒作用,而TBP-1对G(−)菌没有影响。由于G(−)细菌的分子正电荷数不同,导致它们与细胞壁上的阴离子型脂多糖结合亲和力明显不同所致。带有两个正电荷的TBP-2可以与脂多糖发生更强的相互作用,取代稳定脂多糖结构的二价阳离子,导致通透性屏障形成“裂缝”,从而部分进入周质间隙,产生活性氧,破坏G(−)细菌的生物分子。
2)在光灭活实验中使用的条件下,AIE PSs可以选择性地成像并杀灭哺乳动物细胞上的细菌。因此,在需要保留有益的G(−)菌的生物医学应用中,TBP-1有望成为一种有效的G(+)抗菌剂。TBP-2具有作为G(+)和G(−)抗菌剂的潜力。研究工作表明,PSs上的正电荷数量对抗菌效果起着重要的作用。
这项工作为新型抗菌材料的合理设计提供了新的思路,并将促进AIE PSs在生物医学应用中的发展。
Shi, X., et al, Killing G(+) or G(−) Bacteria? The Important Role of Molecular Charge in AIE‐Active Photosensitizers. Small Methods, 2020
DOI:10.1002/smtd.202000046
https://doi.org/10.1002/smtd.202000046



















