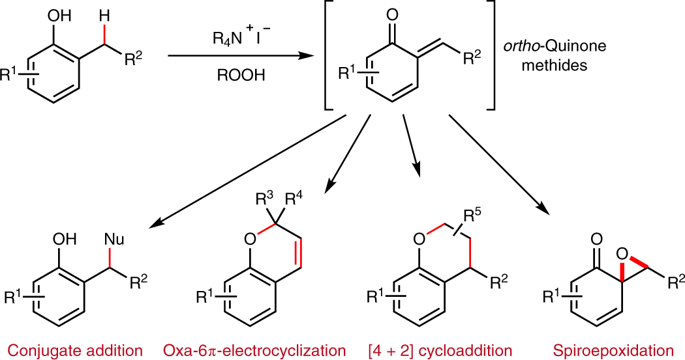
邻位醌有机物(Ortho-Quinone methides, o-QMs)在有机合成领域中是重要的中间体,由于分子由电中性的非芳环结构和两性离子(zwitterionic)芳环结构组成,这种分子具有独特的化学反应性。o-QM在一些关键生物体反应中起到重要作用。
自从2000年左右,这种o-QM分子逐渐在有机反应中起到越来越重要的作用([4+2]环加成反应,电环化反应,共轭加成,螺环氧化),该反应通常以取代的苄基分子在酸或碱催化作用,经过酚的氧化过程得到。此外,该反应中间体可以通过仿生方法经由邻位烷基苯酚在金属氧化剂或过渡金属复合物作用下进行氧化反应进行。
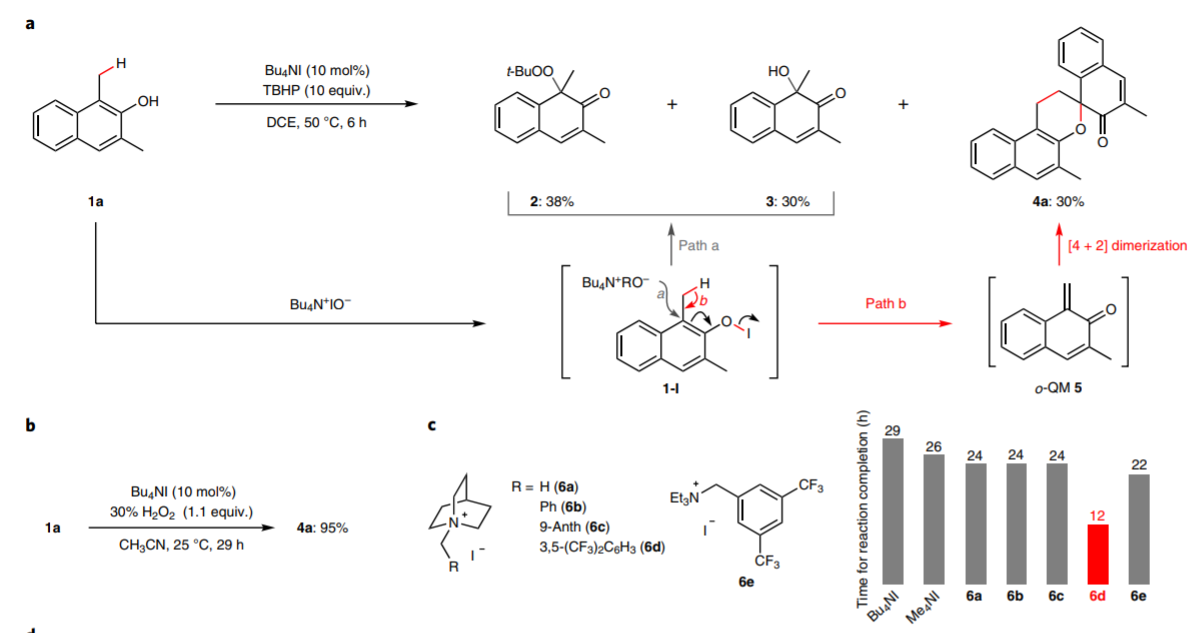
日本名古屋大学的Ishihara Kazuaki 最近发明了使用TBHP作为氧化剂和偶联试剂用于苯酚的高碘化合物(hypoiodite)催化的反应,该反应通过苯酚的氧化去芳化过程进行(Heterocycles, 2017, 95, 1132–1147)。
日本名古屋大学的Ishihara Kazuaki等发表了一种不用过渡金属氧化剂,将邻位烷基苯酚转化为邻位醌有机物的方法。这种方法实现了比较好的选择性,在各种多组分反应中(比如[4+2]环加成反应,电环化反应,共轭加成,螺环氧化)展现比较好的反应性。
[4+2]级联氧化加成。作者使用萘酚或苯酚和5倍、50倍的乙基乙烯基醚反应,加入10 mol %的催化剂,1.1倍氧化剂。在25 ℃中反应,反应能够以[4+2]成环过程反应,收率能达到中等到较高收率。
苯酚和1.1倍的丙二氰同样能够实现[4+2]氧化环合反应。作者发现对6种底物都有中等收率,并且反应产物体现一定的手性。对于萘酚分子中具有烯烃官能团的烷基取代基能够实现分子内的[4+2]环化反应,反应以中等到高收率进行。
作者对苯酚和丁二酰亚胺之间的氧化反应进行了探索。该反应能够对酚羟基邻位甲基上的C-H碱活化,并加成丁亚酰亚胺。苯酚羟基对位上甲基的C-H键同样能够经由此过程氧化加成酰亚胺官能团或其他亲核官能团。
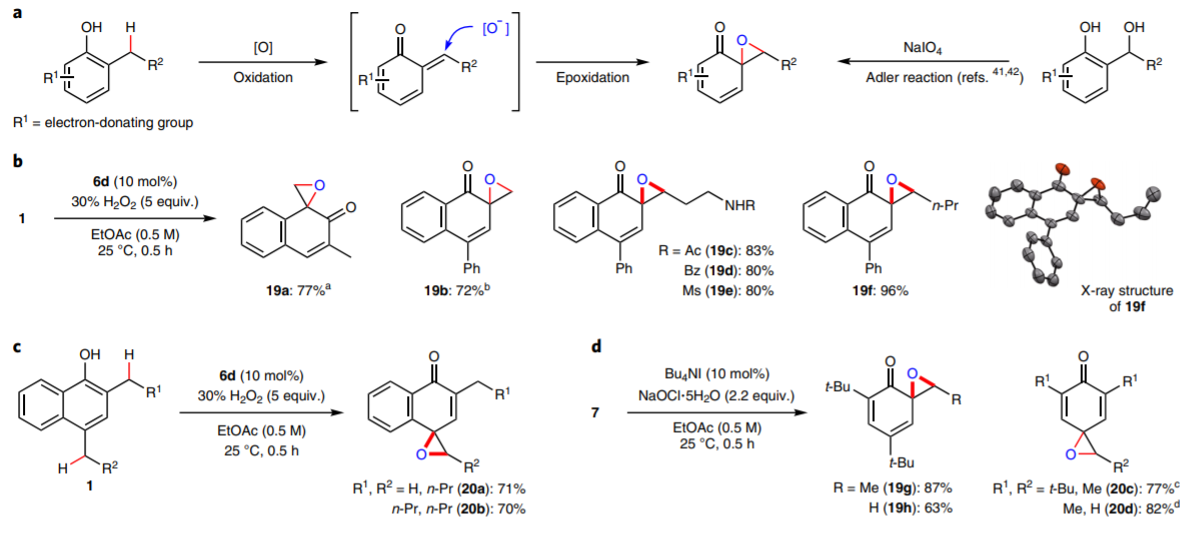
苯酚上邻位或对位上的C-H键活化后,能够和氧化剂(H2O2或NaIO4)反应,在α-C位点上通过氧化反应,生成环氧官能团。

参考文献
Muhammet Uyanik; Kohei Nishioka; Ryutaro Kondo; Kazuaki Ishihara*
Chemoselective oxidative generation of ortho -quinone methides and tandem transformations
Nat. Chem. 2020, DOI: 10.1038/s41557-020-0433-4
https://www.nature.com/articles/s41557-020-0433-4