
基于金属的治疗剂已被广泛研究用于疾病治疗,但仍面临脱靶和急性毒性等挑战,精确控制金属离子的释放成为迫切需要解决的问题。近日,武汉大学张先正教授课题组设计了一种通过近红外(NIR)诱导的光动力疗法(PDT)控制氧化条件,实现按需激活和释放金属离子的纳米体系(PAM),应用于抗肿瘤和抗菌领域。
示意图
本文要点
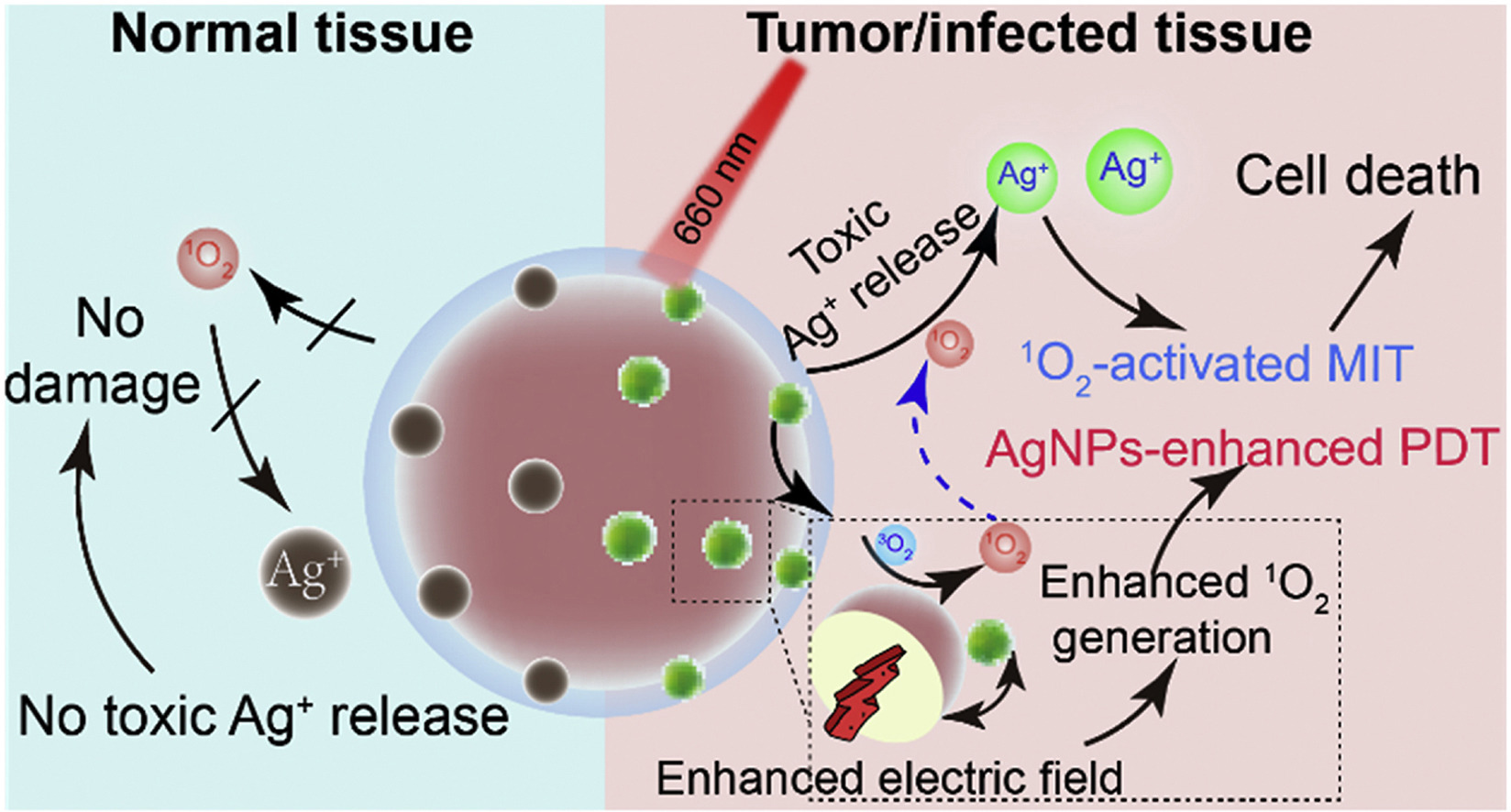
1) 研究人员将银纳米颗粒(AgNPs)修饰到卟啉多孔配位网络(PCN)上,并用具有炎症靶向能力的中性粒细胞膜(NM)进一步修饰,来构建PAM。
2)PAM在没有照射的情况下处于非活动状态,不会对正常组织造成损害;然而,在肿瘤或受感染组织处照射近红外辐射时,PCN会局部产生单线态氧(1O2),使AgNPs部分降解以释放出细胞毒性Ag+,以用于金属离子治疗(MIT)。Ag+的光控活化和释放使纳米体系在循环过程中具有生物惰性,并且毒性可以可控地恢复,巧妙地避免了当前金属离子包载过程中不可避免的泄漏问题。
3)由于局部电场效应,掺入的AgNPs可以提高PCN产生1O2的效率。因此,在近红外光的存在下,AgNPs辅助增强的光动力疗法与1O2活化的金属离子治疗之间协同相互作用,使PAM在体内外均显示出优异的抗肿瘤和抗菌能力,且没有明显的副作用。
综上,该研究设计的AgNPs /卟啉MOF纳米体系,能够协同利用金属离子疗法和光动力疗法,用于消除肿瘤和病原体。这种近红外诱导的纳米复合物为设计更多以安全、可控和有效地治疗疾病的生物材料提供有意义的参考。
参考文献:
Lu Zhang et al. Near infrared light-triggered metal ion and photodynamic therapy based on AgNPs/porphyrinic MOFs for tumors and pathogens elimination. Biomaterials. 2020.
https://doi.org/10.1016/j.biomaterials.2020.120029



















