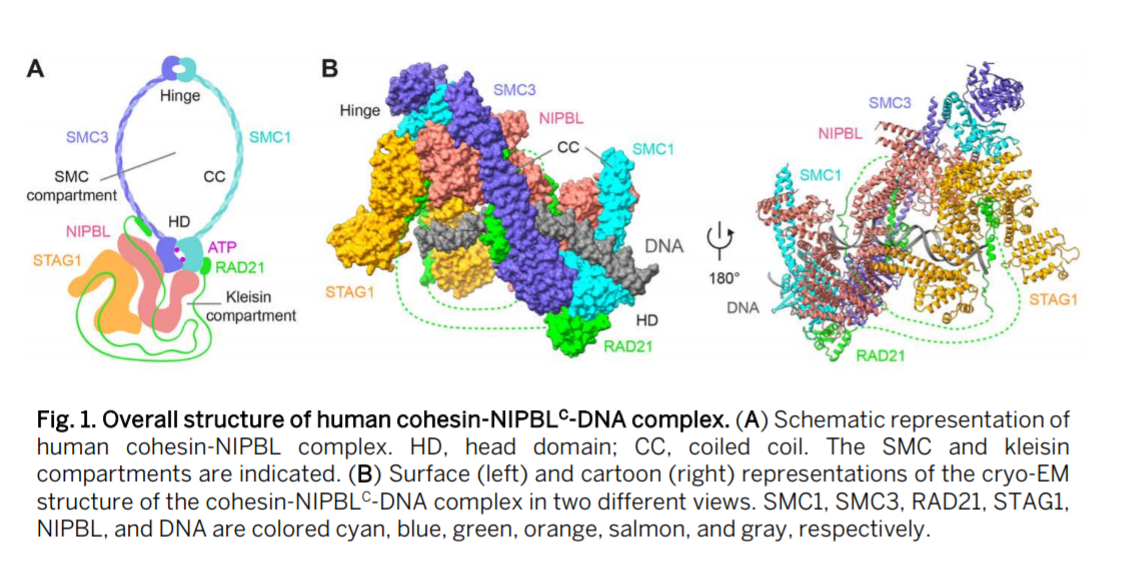
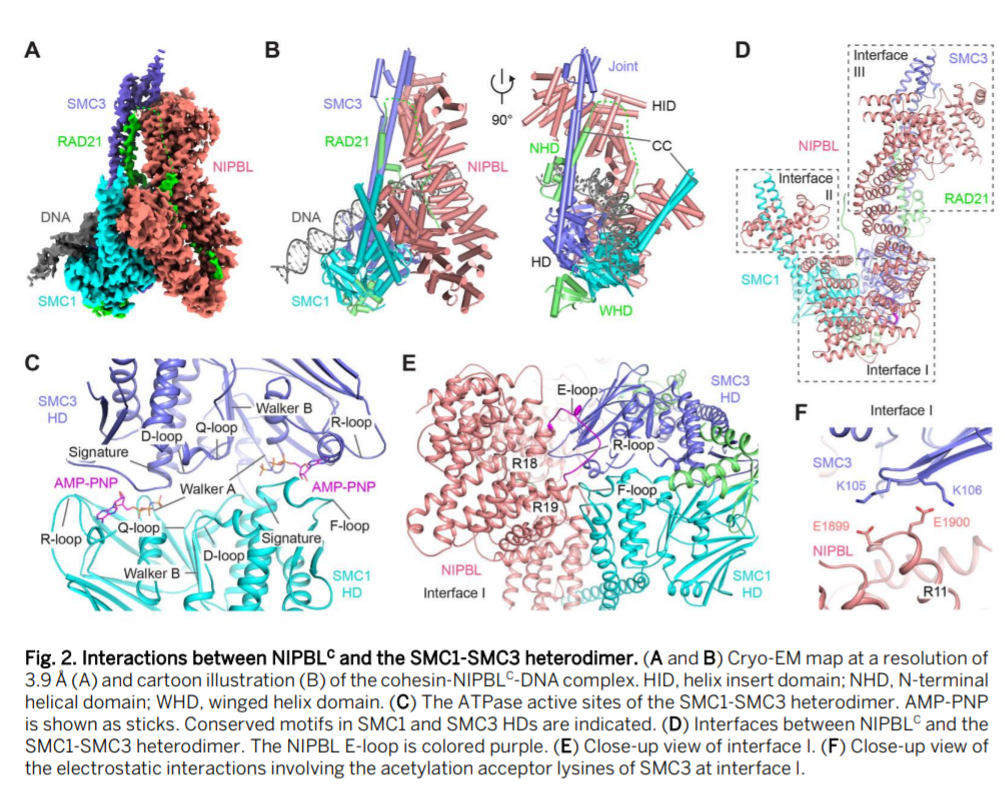
德克萨斯大学西南医学中心Hongtao Yu、Xiao-chen Bai,西湖大学等报道了人源cohesin-NIPBL-DNA复合物的冷冻电镜结构解析结果。作为一种环状ATP酶,真核基因组通过挤压并且通过拓扑包埋(topologically entrapping)改善DNA环姐妹染色单体的凝聚力,但是目前其中DNA转运的具体过程没有很好的阐释清楚。作者通过cryo-electron microscopy冷冻电镜方法对人源cohensin和NIPBL和DNA结合过程进行分析,结果显示人源cohesin通过和NIPBL很好的接触并共同组成了中央通道,实现了捕获72个碱基对长度的DNA。分析结果显示,NIPBL和DNA促进了人源cohesin的ATP酶头部区域和ATP结合之间的相互作用,cohesin的铰链域(hinge domains)形成”open washer”构型停靠在STAG1单元上,这种结构实现了NIPBL和DNA协同作用实现了激发cohesin,此外本工作为cohesin和DNA相互作用的过程提供了深入的理解。
参考文献
Zhubing Shi, Haishan Gao, Xiao-chen Bai*, Hongtao Yu*
Cryo-EM structure of the human cohesin-NIPBL-DNA complex,Science 2020,
DOI:10.1126/science.abb0981
https://science.sciencemag.org/content/early/2020/05/13/science.abb0981


















