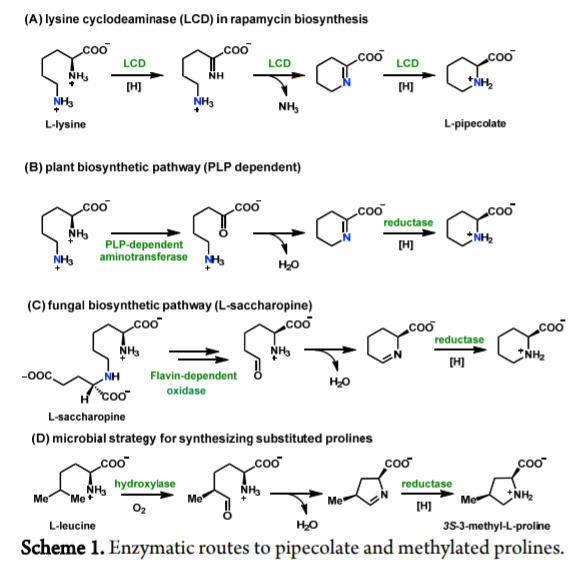
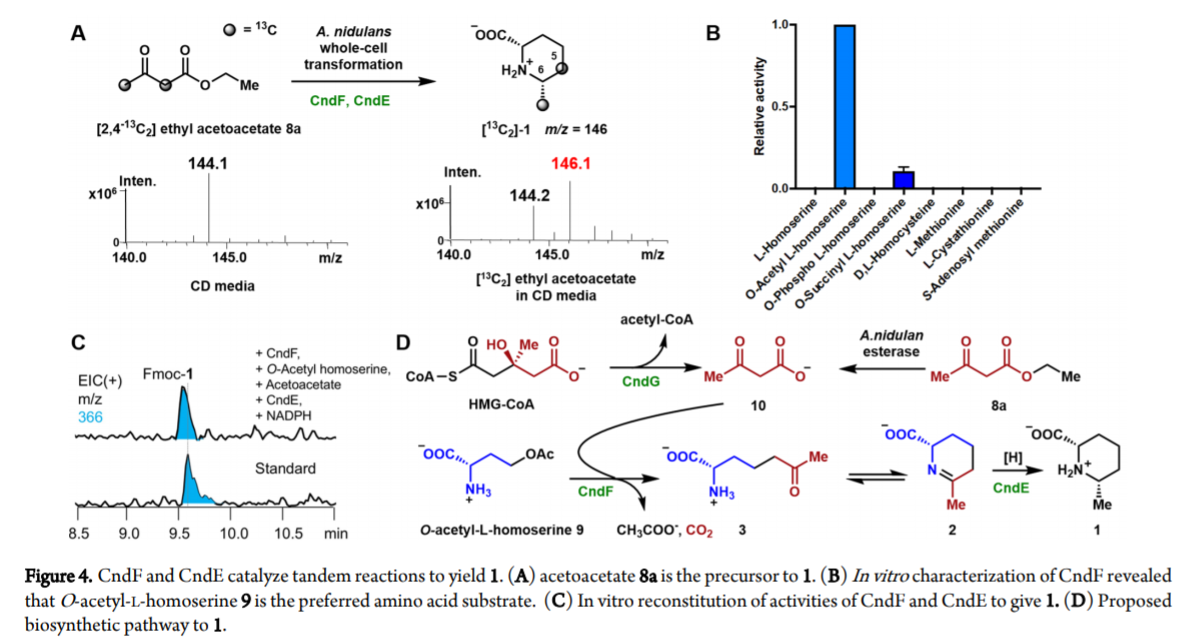
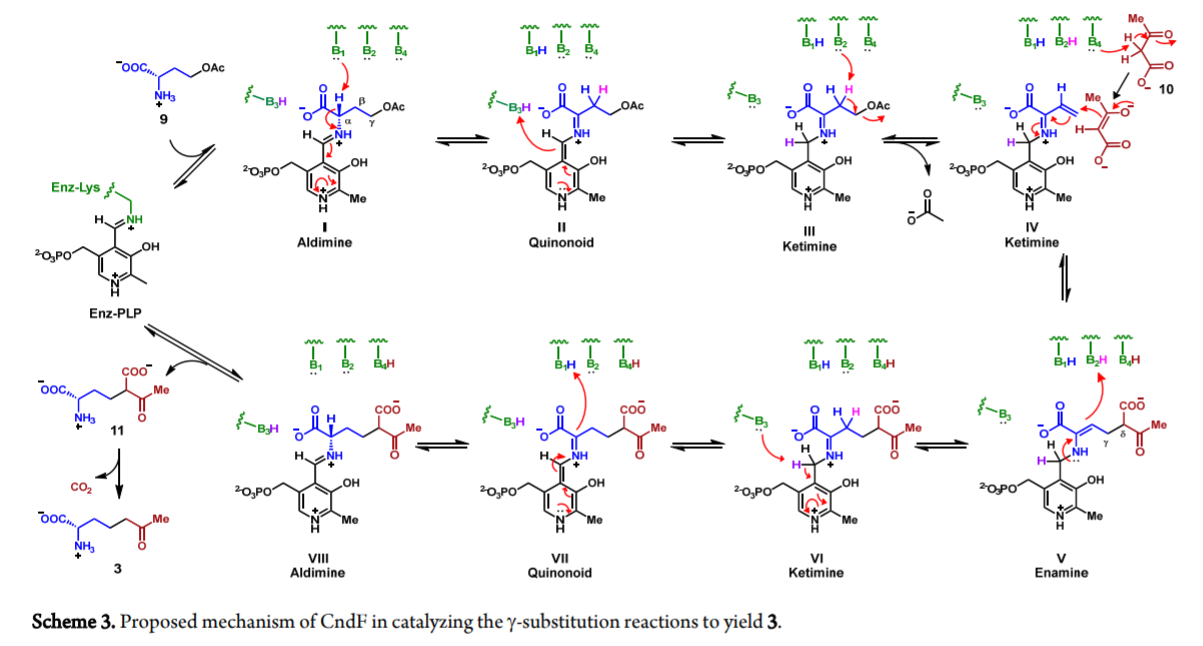
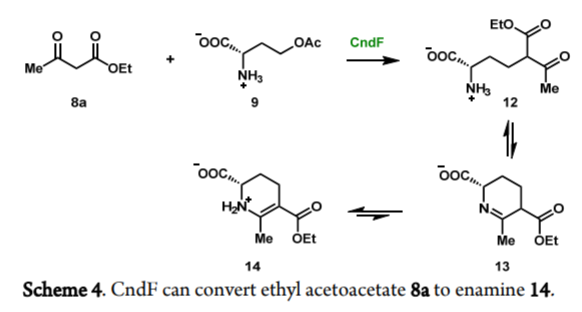
磷酸吡哆醛PLP(Pyridoxal phosphate)对应的酶能够对L-氨基酸的α,β,γ-位点进行催化转化反应。这种酶在非蛋白原氨基酸的生物合成中起到重要作用,并且作为天然产物中重要组分,能作为高效的生物催化剂。目前加州大学洛杉矶分校Yi Tang、MIT麻省理工学院等发现通过两步酶合成方法制备了(2S, 6S)-6-哌酸甲酯 (methyl pipecolate)。其中关键的CndF酶在和PLP辅酶配合环状Schiff碱的配合过程中生成(S)-2-氨基-6-氧庚酸,CndE还原酶生成(2S, 6S)-6-哌酸甲酯。对CndF酶的相关生物化学表征结果显示O-乙酰基-L-高丝氨酸(O-acetyl-L-homoserine)的γ-消除反应生成乙烯基甘氨酸酮亚胺(vinylglycine ketimine),该分子在乙酰乙酸亲核进攻(S)-2-氨基-6-氧庚酸过程中生成Cγ-Cδ化学键并进行γ-取代反应。CndF酶对多种β-酮羧酸化物和酯等有反应兼容性。通过曲霉菌株(Aspergillus strain)对CndF和CndE进行表达,能够将烷基-β-酮的酯化物反应生成6位取代的L-哌盐(pipecolates),以上结果显示CndF酶能够有效的扩展PLP酶的反应底物范围。
参考文献
Mengbin Chen, Chun-Ting Liu, and Yi Tang*
Discovery and Biocatalytic Application of a PLP-Dependent Amino Acid γ-Substitution Enzyme that Catalyzes C-C Bond Formation,J. Am. Chem. Soc. 2020
DOI:10.1021/jacs.0c03535
https://pubs.acs.org/doi/10.1021/jacs.0c03535