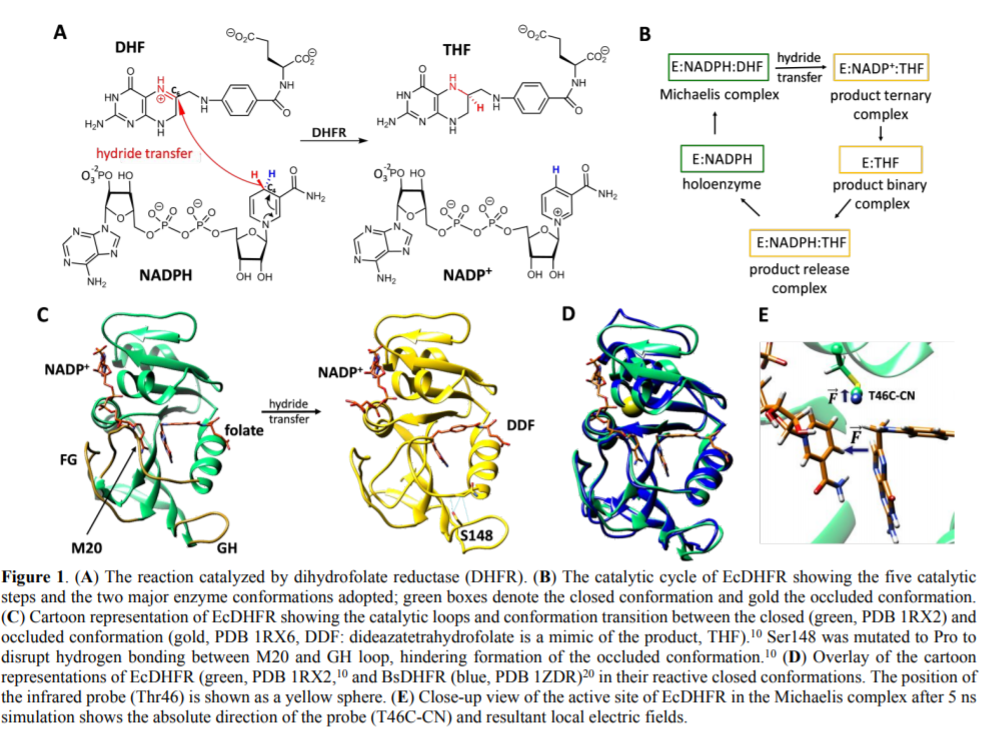
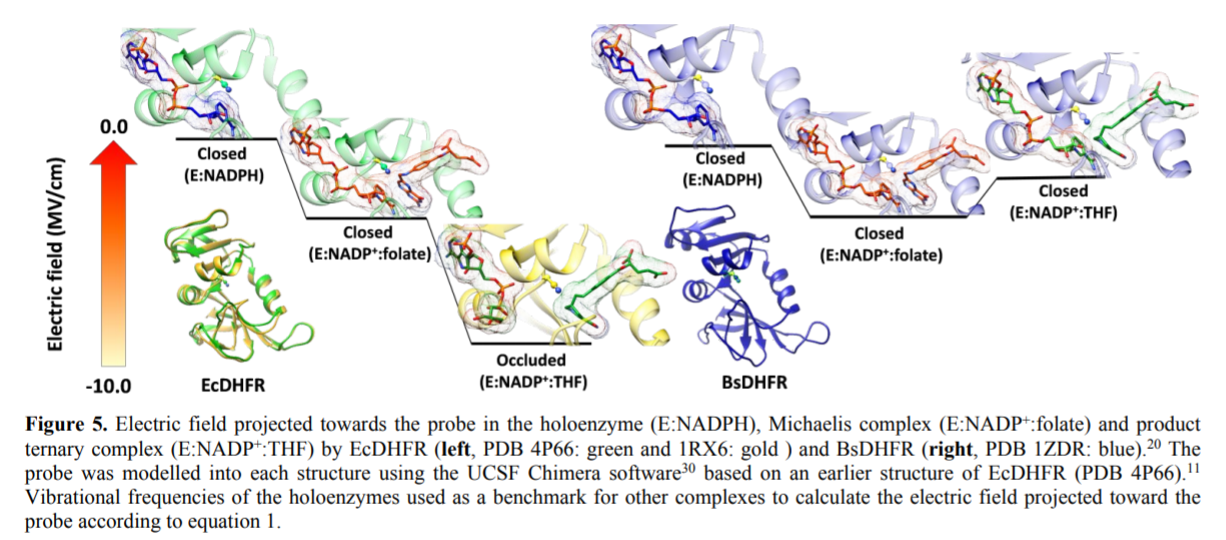
虽然静电作用力在蛋白质的作用中起到重要作用,并且会发生振动斯塔克效应,酶催化反应中的配体-配体静电相互作用对过渡态的影响是个未知问题,卡迪夫大学Rudolf K. Allemann、西班牙海梅一世大学Vicent Moliner等研究了催化反应过程中关键步骤中的静电作用变化情况。
具体的,通过氰基探针分子T46-CN插入到反应中三种二氢叶酸还原酶DHFRs(dihydrofolate reductase)上,分别为大肠杆菌(Escherichia coli)中的EcDHFR,构象受损的变体(EcDHFR-S148P),嗜热脂肪芽孢杆菌(Geobacillus stearothermophilus)上的酶(BsDHFR-S148P)。作者通过对实验和计算方法进行结合,揭示了其中的静电场作用中底物对探针分子上的作用过程。实验结果显示,和之前针对于蛋白质-配体之间的相互作用,这种配体-配体之间的相互作用是为催化反应中提供静电环境的关键。
在之前报道的EcDHFR中大部分的酶并未发生构象变化过程相关基础上,作者认为配体-配体之间的静电相互作用可能在酶催化中起到关键的作用。
参考文献
Aduragbemi S Adesina, Katarzyna Świderek, Louis Y. P. Luk, Vicent Moliner*, and Rudolf K. Allemann*
Electric Field Measurements Reveal the Pivotal Role of Cofactor-Substrate Interaction in Dihydrofolate Reductase Catalysis, ACS Catal. 2020
DOI:10.1021/acscatal.0c01856
https://pubs.acs.org/doi/10.1021/acscatal.0c01856


















