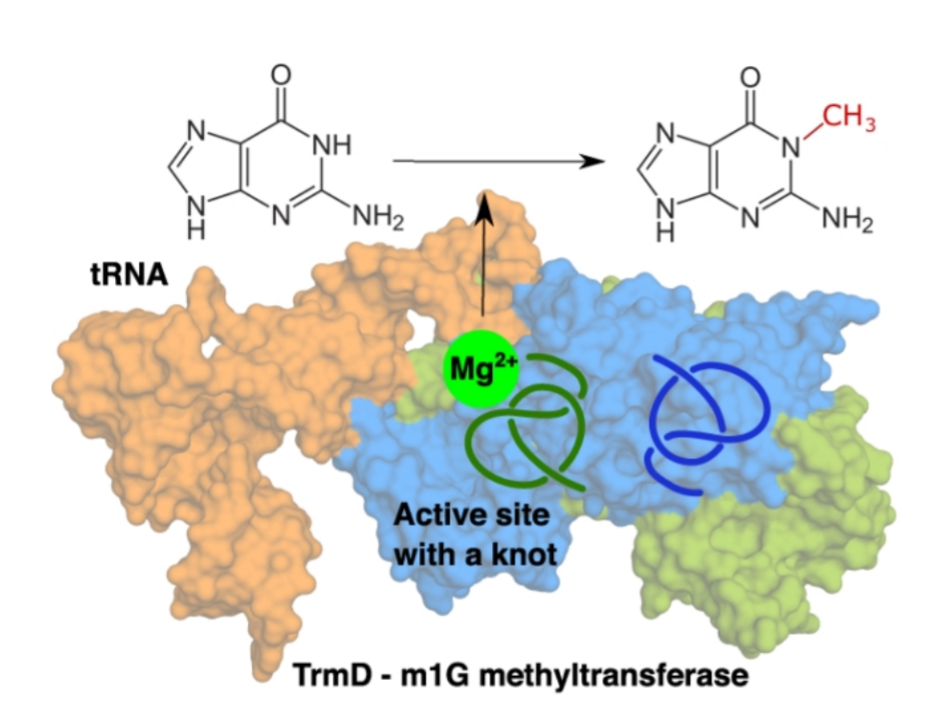
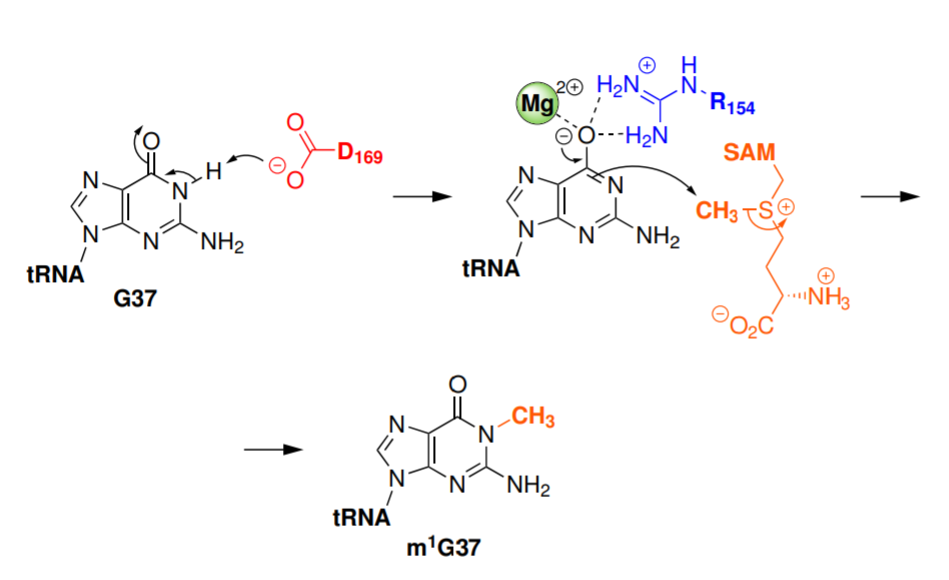
Mg2+在细菌特异性甲基转移酶(TrmD)的催化反应合成生命中重要的m1G37-tRNA起到重要作用,但是目前关于TrmD中Mg2+的结构和催化反应机理并不清楚。波兰华沙大学Joanna Ida Sulkowska、Marcin Kalek等通过动力学模拟方法对TrmD酶活性位点上Mg2+结合方式进行研究,结果显示Mg2+可能通过两个天门冬氨酸和一个谷氨酸配位,在该结构位点上,Mg2+会和SAM辅酶甲基供体上的羧基发生相互作用,作者通过相关实验方法对计算模拟结果进行验证,在实验中发现了Mg2+和结合体残基的催化活性,Mg2+的结合物引发了SAM结构产生了有利于甲基转移反应的独特构象。动力学化学计算结果显示,当Mg2+存在的过程中甲基转移反应在能量上有优势,并且产生了knot-fold构象促进催化反应的进行。该研究结果为开发适配于Mg2+-TrmD的抗菌药(antibacterial drug)提供了见解和经验。
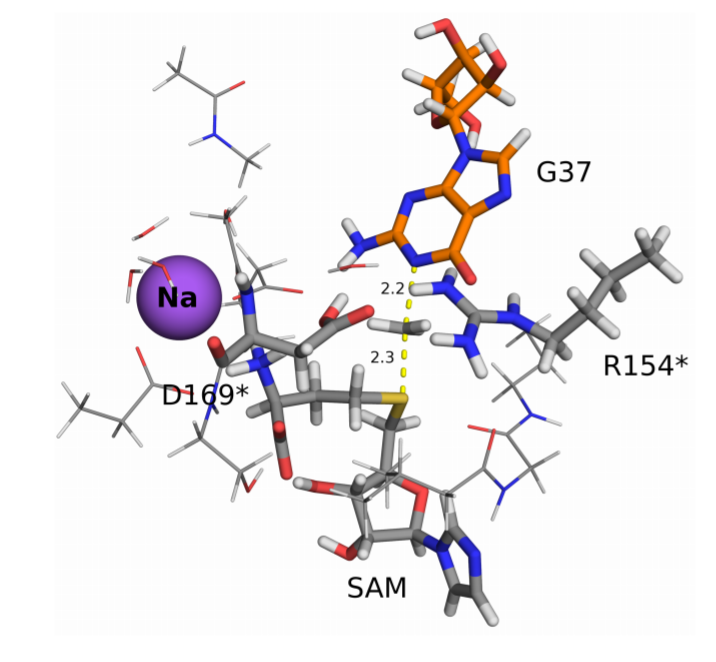
动力学模拟过程清晰的展示了Mg2+和TrmD的结合作用,其中结合位点由E116,D169*,D177*和SAM之间的相互作用进行,动力学研究过程中显示,Mg2+在溶液中进入到结合位点上,特别时虽然在二聚体结构的酶中有两个结合位点,一次只能在其中一个位点上进行Mg2+的结合,该作用同样在实验中得以验证,该位点同样能结合Na+,但是对Na+的结合作用较弱。该发现提供了一种之前未发现的TrmD的诊疗靶点。
参考文献
Agata Perlinska, Marcin Kalek*, Thomas Christian, Ya-Ming Hou, and Joanna Ida Sulkowska*
Mg2+-Dependent Methyl Transfer by a Knotted Protein: A Molecular Dynamics Simulation and Quantum Mechanics Study, ACS Catal. 2020
DOI:10.1021/acscatal.0c00059
https://pubs.acs.org/doi/10.1021/acscatal.0c00059


















