人体组织和器官的体外三维微生理表征正在成为人体病理生理学的重要模型,并将对药物发现和开发过程产生重大影响。一个长期的需求是在这样的3D模型中创建微血管网络,特别是对高代谢需求的组织,如肝脏、胰腺和中枢神经系统。在此,麻省理工学院Paula T.Hammond等人报道了一种简便的方法,通过将可降解的水凝胶微珠包覆诱导的多能干细胞来源的内皮细胞(MB-iPSC-ECs)嵌入致密的上皮组织中,在新生3D培养模型中驱动血管生成。
本文要点:
1)描述了一种优化微珠支架线索的方法,独立于外部环境,通过评估iPSC-EC对微珠的粘附特性,以及它们如何影响细胞均匀覆盖微珠和进行新生血管生成的倾向。
2)将MB-iPSC-ECs包覆在PEG水凝胶中,系统地改变了微珠和周围环境中整合素靶向肽基序的相对浓度,发现0.1-0.25 mM的最佳微珠支架配体体系促进了iPSC-EC单层的形成和随后侵入到合成基质中。
3)利用这些结果来预测在共培养肝癌(HEPG2)微组织模型中促进MB-iPSC-ECs血管生成所需的粘附配体的状态。这种模块化可降解微珠平台具有促进血管生成的潜力,最终可能支持多种细胞密集组织的血管化。
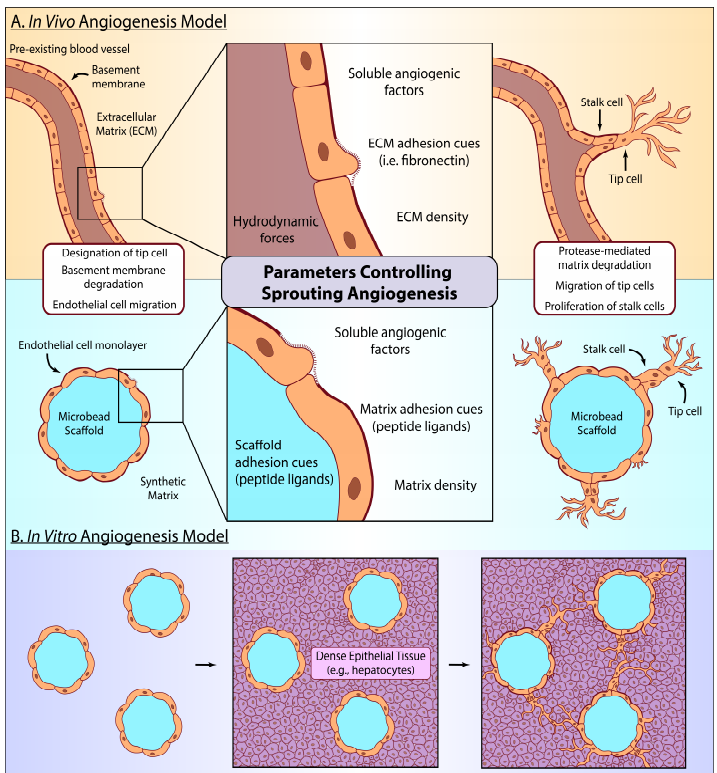
Marianna Sofman, et al. A Modular Polymer Microbead Angiogenesis Scaffold to Characterize the Effects of Adhesion Ligand Density on Angiogenic Sprouting, Biomaterials, 2020.
https://doi.org/10.1016/j.biomaterials.2020.120231


















