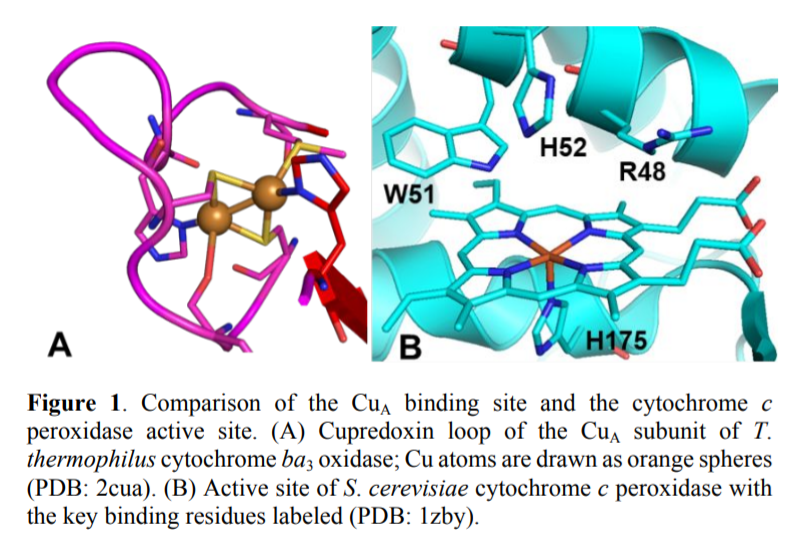
金属蛋白中金属结合位点一级/二级配位球结构的表征,为设计高活性功能性金属蛋白提供了经验。但是目前蛋白骨架的整体结构和对应的金属蛋白性质之间的关系很少有相关深入研究。其中有两个例子是:一种双核CuA中心,作为光合成过程/呼吸复合体中电子转移的铜氧还蛋白域;共调控甲烷和氨单加氧酶的蛋白。因此,伊利诺伊大学香槟分校陆艺、斯坦福大学Edward I. Solomon等报道了通过两个CuACcP组成,结构非同源蛋白中的细胞色素C过氧化物酶(CcP)全功能CuA中心。
本文要点
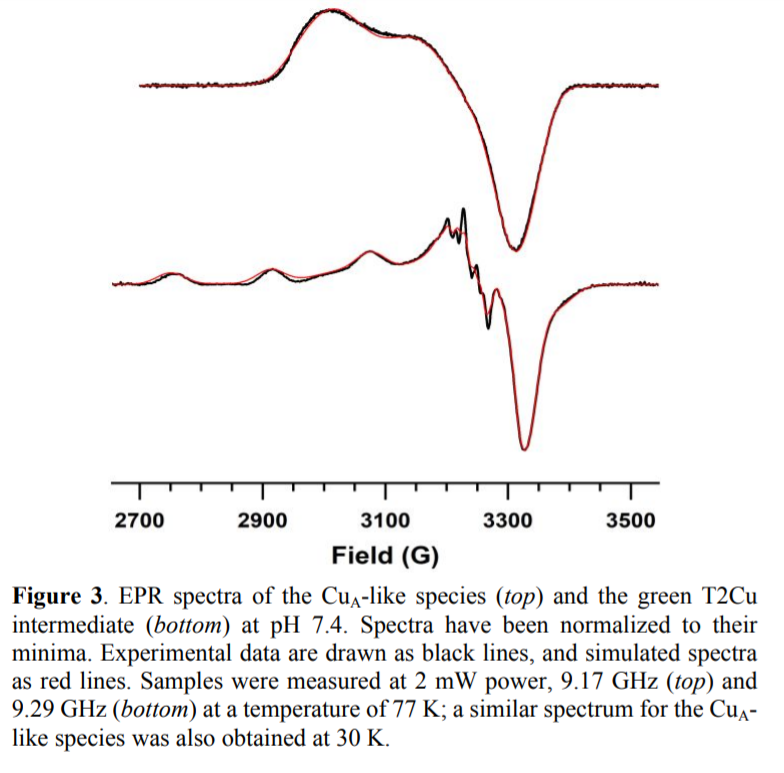
作者通过UVVis光谱,共振Raman,MCD光谱发现CuACcP中价电子处于离域状态。X波段ESR(CW、HYSCORE)测试结果显示,其具有高度收缩的gZ区域,较小的AZ超精细常数值。停留动力学测试结果发现CuA通过T2Cu中间体形成,作者通过EXAFS对Cu结合位点的结构进行表征,发现了与其配位的Cys,His残基,展示了三个残基(R48C,W51C,His52)严格按照一种α-螺旋排列的Cu螯合结构,同时His175通过对血红素配位螺旋进行重排进而稳定双核配合物。
通过非同源血红素蛋白作为结构骨架,构建了和本征CuA中心类似的双核Cu,并展现了类似的电子学性质、还原性、电子转移性质。ESR表征结果显示得到的双核Cu中的Cu-Cu键具有III型价电子结构,还原电极电势和本征CuA位点类似。同时这种合成双核Cu中的AZ超精细耦合常数是已报道的结果中最低值。本工作的意义在于展示了在蛋白中能够设计复杂结合位点结构,并且无需严格遵守其本征结构。
作者介绍
陆艺教授,1986年毕业于北京大学化学系,1992年获UCLA(美国加州大学洛杉矶分校)博士学位,1992-1994年在加州理工学院化学系Harry B. Gray教授做博士后研究工作。随后于1994年入职伊利诺伊大学香槟分校。研究领域涉及生物无机化学及其在生物医学工程、环境工程、化学工程等方面的应用,在金属蛋白的设计与工程、酶催化工程、DNA和RNA的结构和活性等方面开展了深入研究,并将相关研究成果应用于生物传感器、环境工程等领域,取得了卓有成效的成果。他曾获得多项荣誉,包括美国国家科学基金会特殊创造力奖(Special Creativity Award), 美国科学进步协会Fellow奖(AAAS Fellow),霍华德休斯医学研究所教授(HHMI Professor)奖等。陆教授发表过大约180 篇科研论文,包括英囯《自然》杂志, 美国 PNAS, JACS杂志等, 同时也获得了多项教学荣誉,美国《科学》杂志曾发表文章讨论他在激发学生对科学的兴趣方面的大胆尝试,创办了科技公司(www.ANDalyze.com)。
网站:http://lulab.scs.illinois.edu/
参考文献
Evan N. Mirts, Sergei A. Dikanov, Anex Jose, Edward I. Solomon*, and Yi Lu*
A Binuclear CuA Center Designed in an All α-Helical Protein Scaffold, J. Am. Chem. Soc. 2020
DOI:10.1021/jacs.0c04226
https://pubs.acs.org/doi/10.1021/jacs.0c04226


















