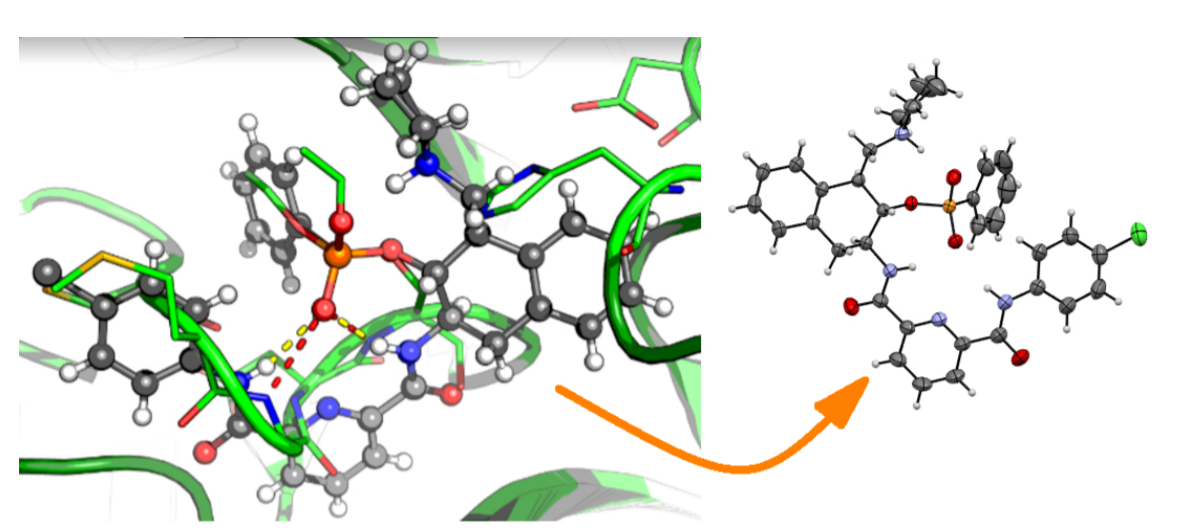
酶是迄今为止活性活性和选择性最高的一类催化剂,虽然这些催化剂相关研究经历了很长时间,构建拟酶结构催化剂仍具有较大挑战,并且具有一定瓶颈。有鉴于此,西班牙萨拉曼卡大学Joaquín R. Morán、Ángel L. Fuentes de Arriba等报道了基于水解酶(hydrolases)三维结构中的关键催化残基构建相关分子,设计构建了胰凝乳蛋白酶(chymotrypsin)和N终端水解酶的体积轻巧分子人工酶。
本文要点:
(1)
作者在20 ℃中考察了乙酸乙烯酯的酯交换反应,结果显示该反应得以很好的进行,能够在低于10 min过程中完成脱乙酰基。通过DFT、X射线衍射对反应中间体进行模拟,结构显示拟酶中间体和天然水解酶的结构类似。
(2)
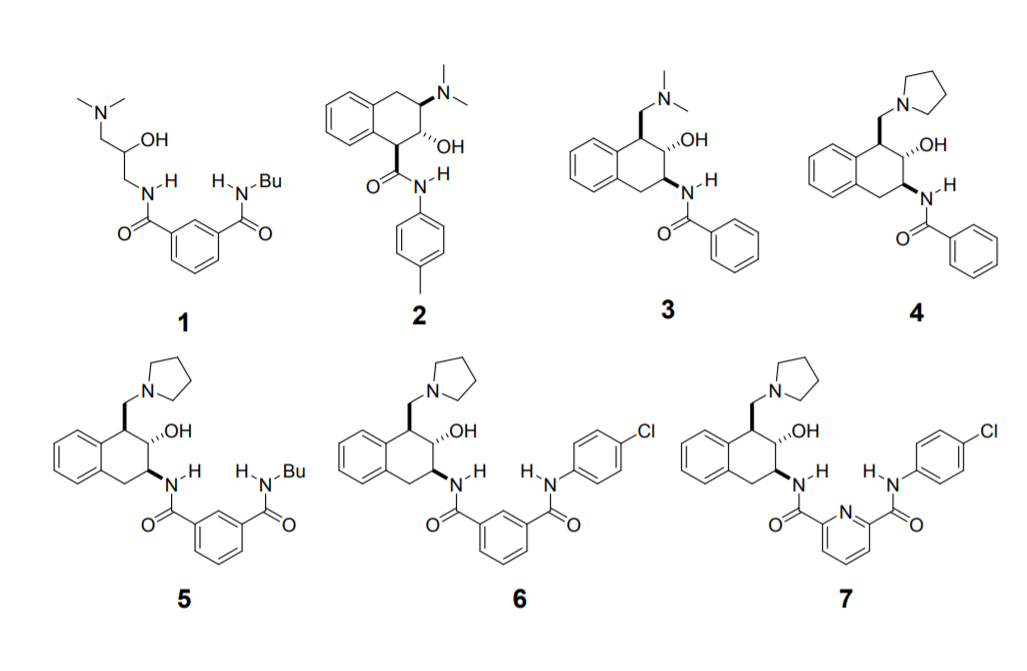
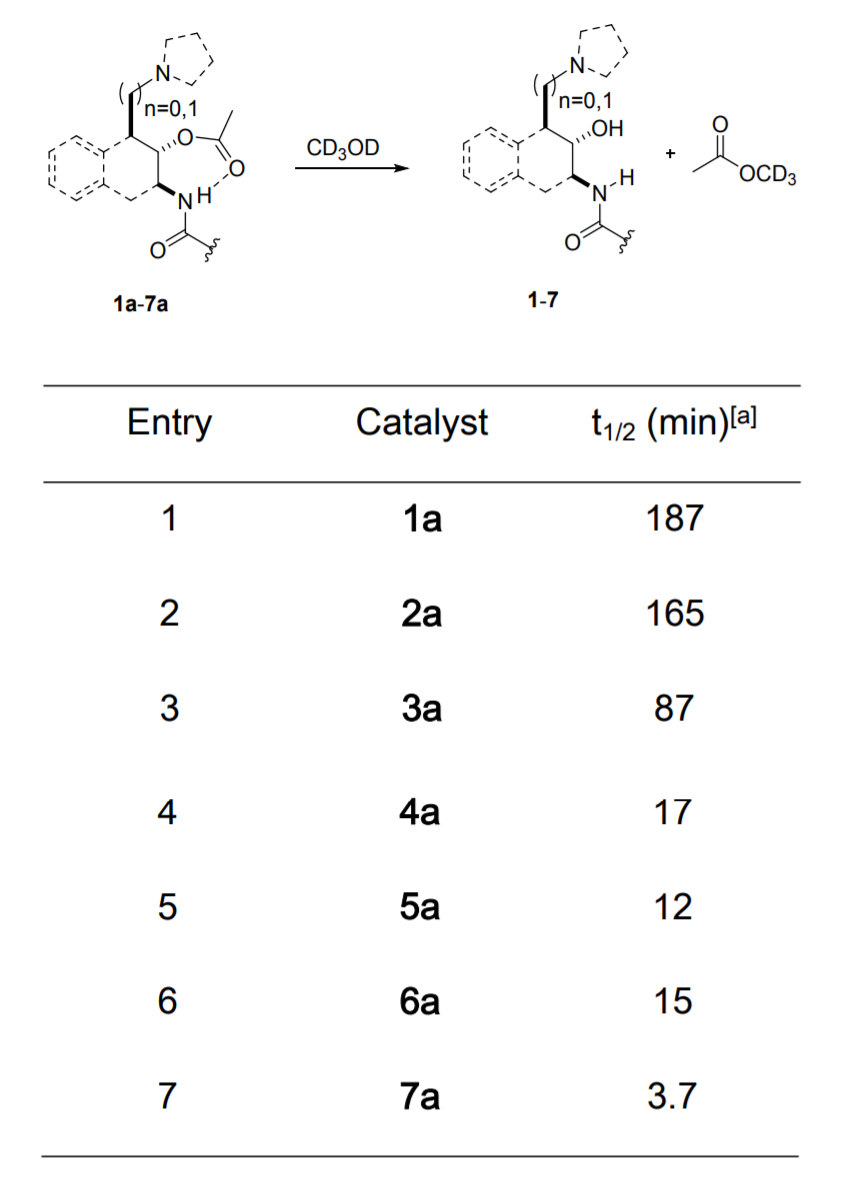
分子拟酶构建。首先对1分子结构的拟酶活性进行表征,结果显示其在酰基中间体的催化水解反应中,该分子设计为可溶解于氯仿中模拟水解酶的活性位点。动力学实验结果显示,该反应的半衰期为187 min,远远低于生物酶催化反应速率(5~10 min就能完成该反应),因此作者进一步对拟酶的结构进行优化。2号催化剂的反应速率进一步提高,反应的半衰期降低了20 min。随后作者设计了1,3-胺基醇结构并组装到催化剂中(这个结构和水解酶中的1,2-胺基醇结构不同),该1,3-胺基醇结构在H2O分子能够结合并在-NH2和-OH之间转移质子,避免了形成4元环结构,并在3号催化剂中反应的半衰期达到87 min。随后通过进一步的对3号催化剂修饰,具体通过将二甲胺基官能团替换为吡咯烷结构,反应速率提高了5倍,随后通过间苯二甲酸引入NH后,反应半衰期降低为12 min。
参考文献
José J. Garrido-González, Mª Mercedes Iglesias Aparicio, Miguel Martínez García, Luis Simón, Francisca Sanz, Joaquín R. Morán*, and Ángel L. Fuentes de Arriba*
An Enzyme Model which Mimics Chymotrypsin and N-Terminal Hydrolases, ACS Catal. 2020
DOI: 10.1021/acscatal.0c02121
https://pubs.acs.org/doi/10.1021/acscatal.0c02121





















