利用pH/ROS/MMP-2三响应性纳米药物载体,中山大学刘杰联合美国耶鲁大学Zhaozhong Jiang等人开发了一种新的化学/光动力学联合治疗实体瘤的方法。
本文要点:
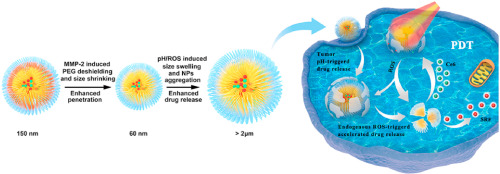
1)设计的聚(乙二醇)肽聚(ω-十五烯内酯-co-N-甲基二亚乙基胺-co-3,3'-硫代二丙酸酯)(PEG-M-PPMT)纳米颗粒(NPs)封装了抗癌药物索拉非尼(SRF)和光敏剂二氢卟酚e6(Ce6),其在含血清的水性介质中稳定,在体内静脉给药后,由于EPR效应,可以有效地在肿瘤中蓄积。
2)当MMP-2在肿瘤细胞外基质中过度表达时,PEG-M-PPMT纳米粒子可部分脱落PEG冠形成更小的颗粒并深入肿瘤组织。肿瘤细胞摄取后,酸性内体pH和细胞内高ROS水平会触发纳米颗粒大量溶胀,从而加速药物释放,进而迅速杀死癌细胞。
3)在目前的化学/光动力联合疗法中,肿瘤内细胞内ROS的产生是通过用外部激光照射激活的光敏剂Ce6来放大的。结果,细胞内ROS浓度的高度提升既可以直接诱导ROS应激的肿瘤细胞凋亡,又可以放大ROS响应性PEG-M-PPMT NPs释放药物的速度,从而获得非凡的治疗效果。
4)特别是,在用负载SRF / Ce6的PEG-M-PPMT NPs进行化学光动力治疗后,裸鼠异种移植的所有人类肺部肿瘤(A549)明显萎缩,约29%的肿瘤被完全根除。此外,负载SRF / Ce6的PEG-M-PPMT NPs对主要器官(如心脏,肝脏,脾脏,肺和肾脏)的体内毒性可忽略不计。
综上所述,基于刺激响应性PEG-M-PPMT NPs的化学/光动力疗法相结合在有效治疗肿瘤方面具有巨大的潜力,。
Man Shu, et al. Tumor microenvironment triple-responsive nanoparticles enable enhanced tumor penetration and synergetic chemo-photodynamic therapy. Biomaterials, 2020.
DOI: https://doi.org/10.1016/j.biomaterials.2020.120574
https://doi.org/10.1016/j.biomaterials.2020.120574


















