分子氧(O2)是一种可持续的氧化剂。氧含量丰富,且氧化性强,但动力学稳定,最终生成的反应产物为水。基于这些原因,理解如何激活O2以及如何引导其反应性沿着所需的反应路径进行是化学研究中的一个长期挑战。基态双自由基O2的活化可以通过转化为单重态氧或通过单电子还原为超氧化物来实现。许多酶通过直接形成金属-氧配位复合物并伴随着球内电子转移促进O2的活化。近日,瑞士巴塞尔大学的Florian P. Seebeck教授等从原子水平揭示了甲酰甘氨酸生成酶(FGE)是一种不寻常的单核铜酶,其O2的活化途径具有不同的策略。
本文亮点:
1)从原子层面揭示了甲酰甘氨酸生成酶进行O2活化的途径与其他Cu依赖酶的本质区别,O2活化过程中不与Cu位点配位。
2)用含AgI的同构体或者用NO代替O2的对照实验都证实了含O2复合物的形成都不会依赖于氧化还原活性。
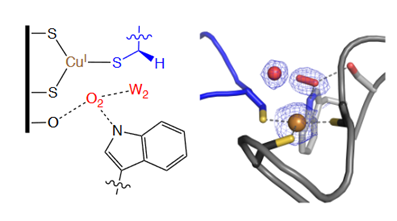
Florian Leisinger, et al. Non‐coordinative binding of O2 at the active center of a copper‐dependent enzyme. Angew,2020.
DOI: 10.1002/anie.202014981
https://doi.org/10.1002/anie.202014981



















