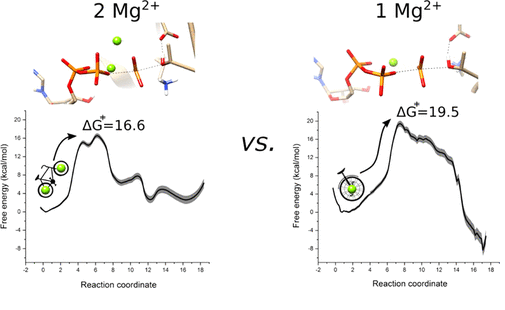
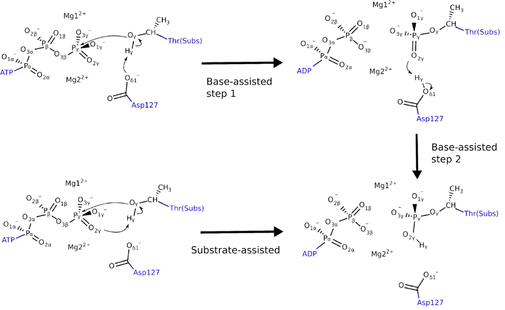
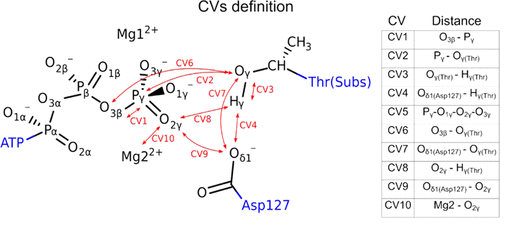
Mg2+离子在蛋白激酶的功能团化中起到官能团化修饰作用,这种修饰作用已经被广泛研究了好多年,此类金属辅酶是如何调控催化反应活性还没有定论,但是已经实现了一些比较重要的进展。比如,人们发现细胞周期蛋白(cyclin)-依赖性激酶2(CDK2)在一个Mg2+配合能够很好的工作,但是只有当存在另一个Mg2+,才能够实现最好的催化活性。通过两个Mg2+同时存在于活性位点上,CDK2才能够很好的进行磷酰基转移反应。有鉴于此,瓦伦西亚大学Iñaki Tuñón、塔尔卡大学Jans Alzate-Morales等报道了通过量子力学/分子力学(QM/MM)自由能计算方法结合自适应字符串法进行计算,发现在含有2个Mg2+的时候,活化能更低,和实验结果很好的相符。通过结构、电子学分析,对体系中当催化位点上同时存在两个Mg2+,关键的辅酶能够更有效的降低静电斥力作用。
参考文献
Rodrigo Recabarren, Kirill Zinovjev, Iñaki Tuñón*, and Jans Alzate-Morales*, How a Second Mg2+ Ion Affects the Phosphoryl-Transfer Mechanism in a Protein Kinase: A Computational Study, ACS Catal. 2021, 11, XXX, 169–183
DOI: 10.1021/acscatal.0c03304
https://pubs.acs.org/doi/10.1021/acscatal.0c03304