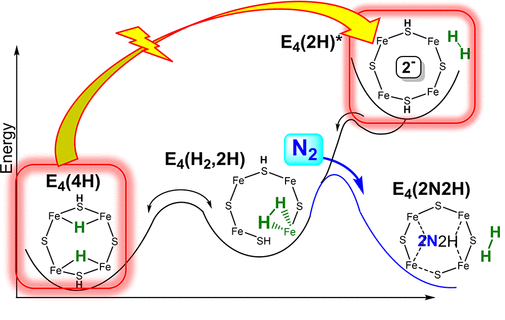
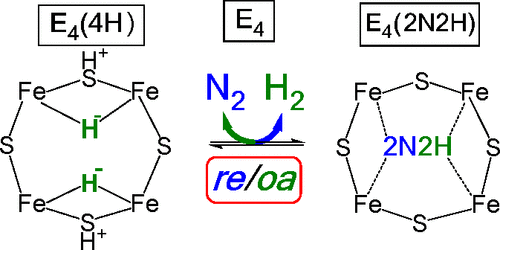
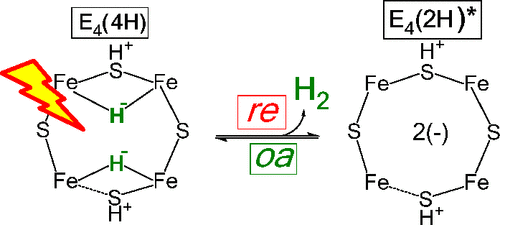
美国西北大学Brian M. Hoffman等报道了在固氮酶(nitrogenase)上进行的N2活化反应中还原消除H2活化N≡N的机理和过程。通过在还原性的FeMo辅酶上通过4个连续还原反应开始反应,生成两个[Fe-H-Fe]桥氢化物中间体形成的态(E4(4H))。目前,在E4(4H)上进行的光催化还原消除反应中发现,在酶催化的光催化还原,通过对FeMo辅酶结构中的金属位点进行2电子还原,生成一种结合H2的复合物(E4(H2, 2H))。生成的缺点子物种导致N2能够结合,同时释放一个分子H2。
参考文献
Dmitriy A. Lukoyanov, Zhi-Yong Yang, Dennis R. Dean, Lance C. Seefeldt, Simone Raugei, and Brian M. Hoffman*, Electron Redistribution within the Nitrogenase Active Site FeMo-Cofactor During Reductive Elimination of H2 to Achieve N≡N Triple-Bond Activation, J. Am. Chem. Soc. 2020
DOI: 10.1021/jacs.0c07914
https://pubs.acs.org/doi/10.1021/jacs.0c07914