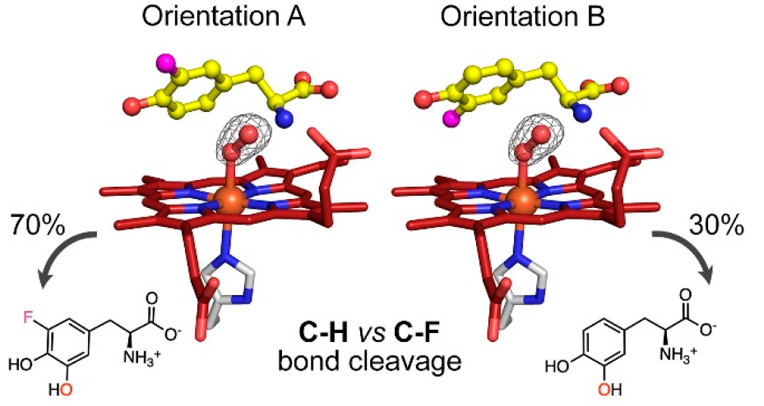
血红素依赖性L-酪氨酸羟化酶(TyrHs)在生物合成天然产物分子中,与以往的非血红素酶相比,是一种新型酶用于DOPA合成。具有代表性的TyrH酶在催化3-氟-L-酪氨酸(3-F-Tyr)底物时,体现C-H、C-F键双重催化活性,但是目前对该反应如何选择性进行两种不同催化反应仍难以理解。有鉴于此,德州大学圣安东尼奥分校刘爱民等报道了从嗜热菌中发现一种新型TyrH,SsTyrH (Streptomyces sclerotialus),随后对其功能、结构进行表征。
参考文献
Yifan Wang, Ian Davis, Inchul Shin, Hui Xu, and Aimin Liu*, Molecular Rationale for Partitioning between C–H and C–F Bond Activation in Heme-Dependent Tyrosine Hydroxylase, J. Am. Chem. Soc. 2021
DOI: 10.1021/jacs.1c00175
https://pubs.acs.org/doi/10.1021/jacs.1c00175