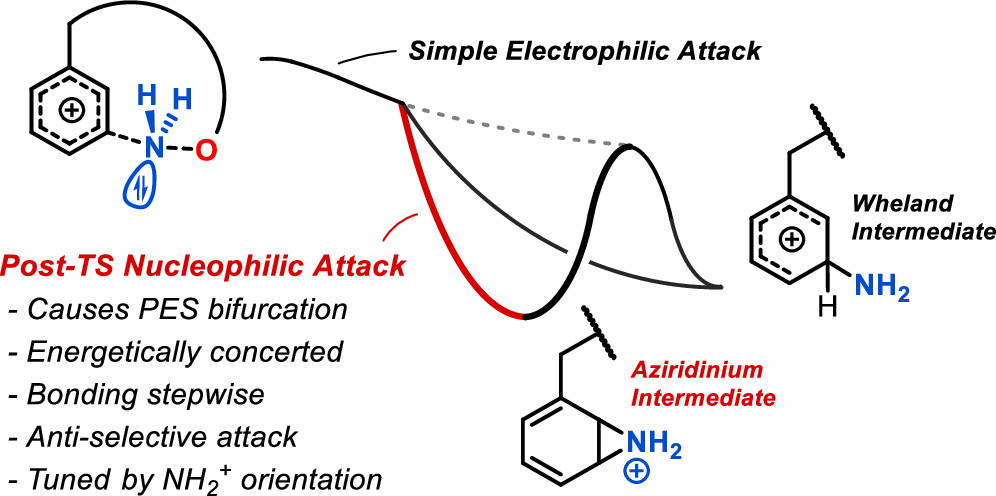
近期研究者报道Fe催化meta间位选择性芳烃胺基化反应,该反应表现了优异的选择性,具有较好的操作性,原子经济性,同时展示了较好的价格优势。有鉴于此,天津大学党延峰、加州大学洛杉矶分校K. N. Houk等报道通过DFT计算、分子动力学模拟结合,对该反应的机理进行研究。计算研究结果显示,该反应通过一种以往未见报道的羟胺-O-硫酸盐(hydroxylamine-O-sulfate)对芳烃的双模式进攻,从而实现通过亲电加成反应生成σ化合物,或者通过亲电-亲核协同加成生成氮丙啶(aziridinium)中间体。
作者通过分子动力学模拟,研究了该反应的时间分辨反应机理,解释了后过渡态亲核进攻的位点选择性。
参考文献
Bo Li, Yuli Li, Yanfeng Dang*, and K. N. Houk*, Post-Transition State Bifurcation in Iron-Catalyzed Arene Aminations, ACS Catal. 2021, 11, 6816–6824
DOI: 10.1021/acscatal.1c01291
https://pubs.acs.org/doi/10.1021/acscatal.1c01291