编码组蛋白H3蛋白的基因发生驱动性突变,导致H3-K27M在儿童中线脑瘤中频繁出现。然而,H3-K27M导致肿瘤发生的确切机制仍不清楚。有鉴于此,爱尔兰都柏林圣三一大学的Adrian P. Bracken等研究人员,发现PRC2和增强子功能的同时破坏是人类后脑神经干细胞中组蛋白H3.3-K27M致癌活性的基础。
本文要点
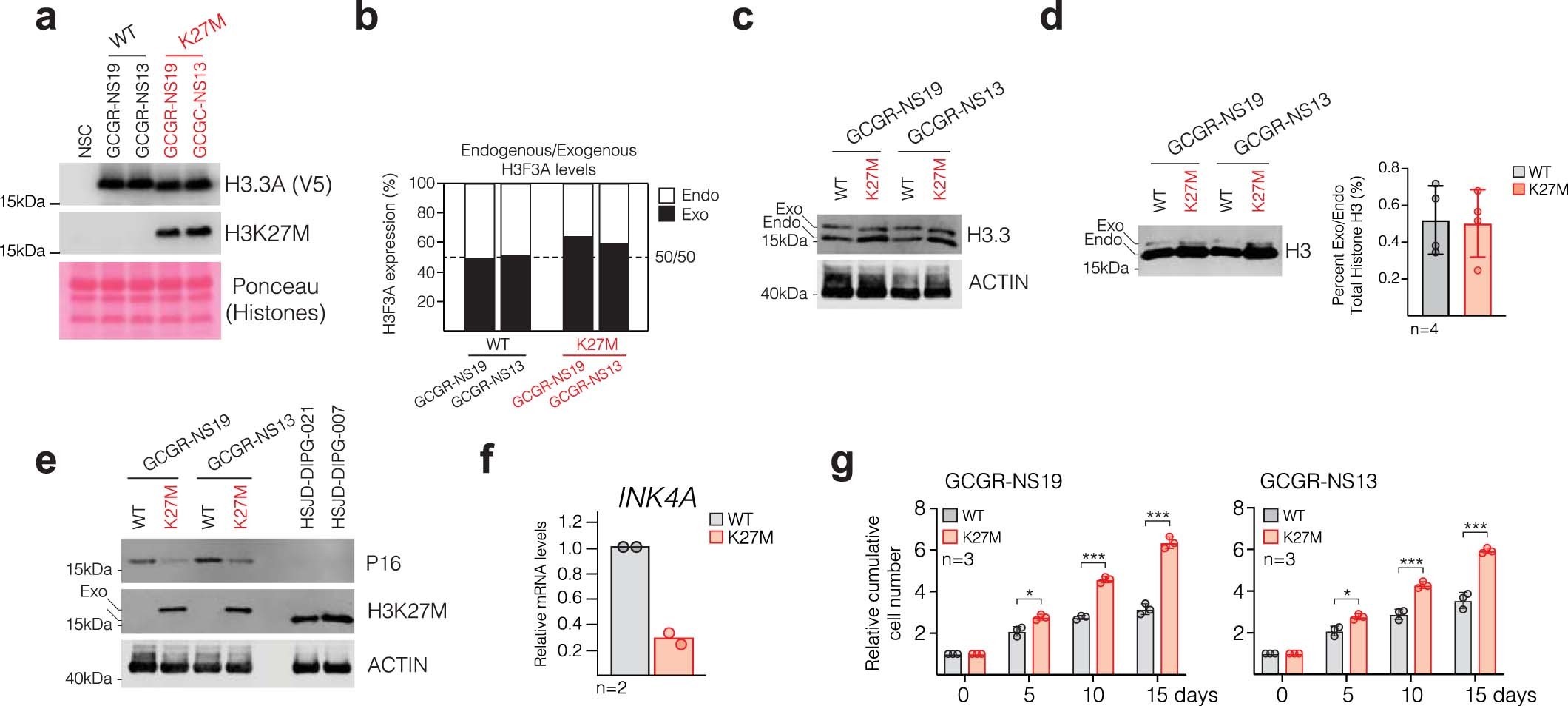
1)研究人员使用人类后脑神经干细胞来模拟了p.Lys27Met替换(H3-K27M)在相关发育背景下对表观基因组景观的影响。
2)表位标记的组蛋白H3.3的全基因组图谱显示,野生型和K27M突变体都大量结合在预先存在的活跃增强子和启动子上,在较小程度上结合在多梳抑制复合物2(PRC2)结合区域。
3)在活跃的增强子部位,H3.3-K27M导致局灶性的H3K27ac丢失,染色质可及性降低,以及附近神经发育基因的转录表达减少。
4)此外,H3.3-K27M富集在PRC2靶基因的一个亚群中,导致PRC2和PRC1的结合增加和转录抑制增强,这可被PRC2抑制剂部分逆转。
本文研究表明,H3.3-K27M不是强加新的转录回路,而是通过破坏PRC2和增强子的功能,将起始细胞锁定在其预先存在的、不成熟的表观基因组状态,从而驱动肿瘤的发生。
参考文献:
Gerard L. Brien, et al. Simultaneous disruption of PRC2 and enhancer function underlies histone H3.3-K27M oncogenic activity in human hindbrain neural stem cells. Nature Genetics, 2021.
DOI:10.1038/s41588-021-00897-w
https://www.nature.com/articles/s41588-021-00897-w


















