最近关于大蛋白纳米孔的发展提出了一种新的方法来分析天然折叠蛋白的结构。有鉴于此,南京大学化学化工学院的黄硕等研究人员,报道了耻垢分枝杆菌孔蛋白A (MspA)纳米矿阱中钙调素的变构转换。
本文要点
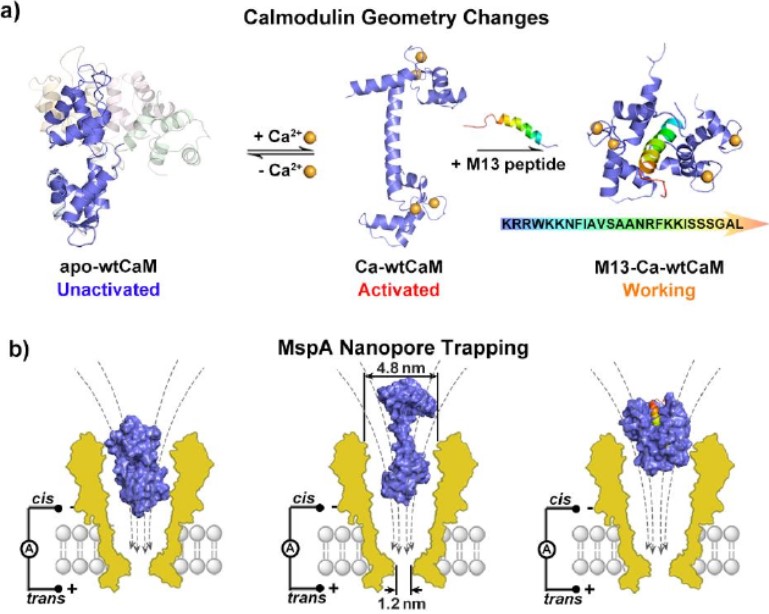
1)研究人员使用耻垢分枝杆菌孔蛋白A (MspA)的大入口和钙离子结合蛋白钙调蛋白(CaM),直接观察蛋白质结构。
2)三种构象包括Ca2+游离,Ca2+结合和靶肽结合的CaM被明确区分。
3)MspA还识别了与疾病相关的突变体CaM D129G,揭示了单个氨基酸替换如何干扰整个蛋白质的Ca2+结合能力。
4)研究了不同离子(Mg2+/Sr2+/Ba2+/Ca2+/Pb2+/Tb3+)诱导的CaM结合能力和聚集效应,并评价了MspA在极端条件下的稳定性。
本文研究工作展示了对CaM不同变构构象的最系统的单分子研究,确认了MspA纳米孔阱提供的高感应分辨率。
参考文献:
Yao Liu, et al. Allosteric Switching of Calmodulin in a Mycobacterium smegmatis porin A (MspA) Nanopore-Trap. Angewandte Chemie, 2021.
DOI:10.1002/anie.202110545
https://onlinelibrary.wiley.com/doi/10.1002/anie.202110545


















