手性环丙烷结构广泛存在于大量的天然产物、非天然产物结构,其中许多手性环丙烷结构具有生物活性,或者能够作为非常重要的合成子。合成1,2,3-三官能团修饰的环丙烷基是非常重要的课题,而且这种分子结构表现了有趣的生物活性。
通过α,β-不饱和羰基化合物通过Michael加成引发的关环反应以立体选择性的方式生成1,2,3-三官能团修饰的环丙烷结构有机分子在有机合成化学领域具有非常高的挑战。Corey和Chaykovsky发展的硫叶立德与缺电子烯烃环丙烷化是一种非常有效和重要的合成方法。
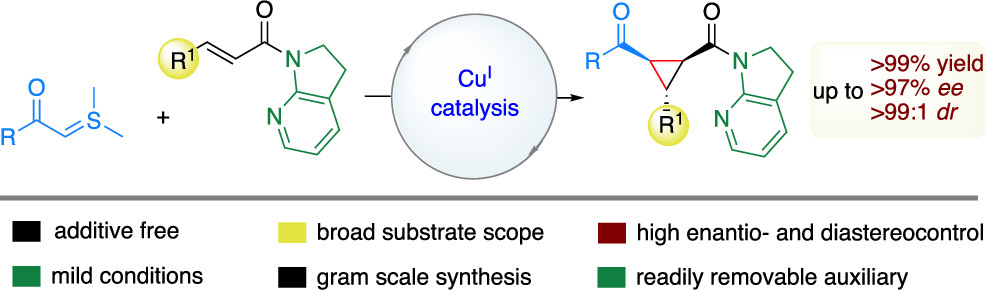
有鉴于此,BIKAKEN公司微生物化学研究所Naoya Kumagai、Masakatsu Shibasaki等报道通过手性Cu(I)催化剂实现了以往方法学无法实现的α,β-不饱和酰胺与硫叶立德的不对称环丙烷基化。这种Lewis酸催化反应体系能够高效率的在温和条件将缺电子烯烃合成1,2,3-三官能团修饰环丙烷,同时保证较高或者优异的对映选择性和立体选择性。
参考文献
Santosh K. Pagire, Naoya Kumagai*, and Masakatsu Shibasaki*, Highly Enantio- and Diastereoselective Synthesis of 1,2,3-Trisubstituted Cyclopropanes from α,β-Unsaturated Amides and Stabilized Sulfur Ylides Catalyzed by a Chiral Copper(I) Complex, ACS Catal. 2021, 11, 11597–11606
DOI: 10.1021/acscatal.1c02723
https://pubs.acs.org/doi/10.1021/acscatal.1c02723