不同结构的双核非血红素酶在多种领域中扮演重要角色,包括代谢、生物技术、药物分子设计、生物降解等。各种双核非血红素酶含有相同的双核铁结构,该结构的组成为组氨酸(histidine)和羧酸根基与双核铁配位,该位点能够还原活化氧气分子,随后启动多种反应过程,包括N-氧化反应、亲电芳基取代反应、羟基化反应等。
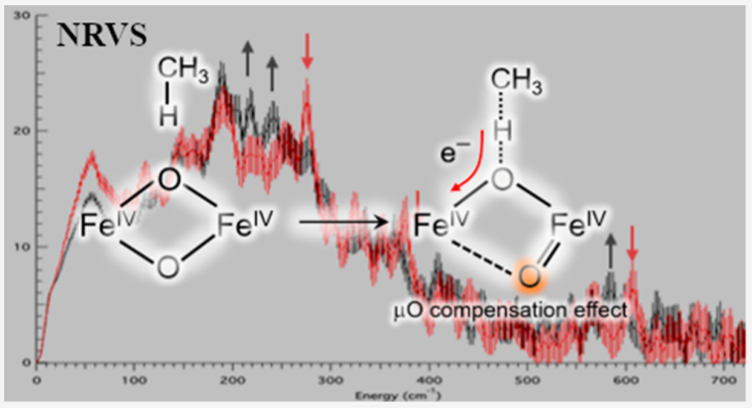
在较低的[Cu]浓度,甲烷氧化菌(Methanotrophic)使用非血红素Fe的双核铁可溶性甲烷单氧化酶(sMMO)将甲烷转化为甲醇,该反应是甲烷参与代谢的第一步。目前人们对Fe(IV)2中间体Q的结构活化惰性C-H化学键(BDE=104 kcal/mol)的机理存在争议,而且近期相关研究发现“开放”和“闭合”状态的结构都具有催化活性。
有鉴于此,明尼苏达大学John D. Lipscomb、韩国科学技术院(KAIST)Kiyoung Park、斯坦福大学Edward I. Solomon等报道使用核磁共振振动光谱NRVS(nuclear resonance vibrational spectroscopy)在液氮温度测试表征Fe(IV)2中间体的立体结构和电子结构,表征结果发现中间体Q在测试过程中就发生快速淬灭,因此给出了中间体的结构、双核铁位点活化甲烷分子的反应过程。
参考文献
Ariel Benjamin Jacobs, Rahul Banerjee, Dory Ellen Deweese, Augustin Braun, Jeffrey Thomas Babicz Jr., Leland Bruce Gee, Kyle David Sutherlin, Lars Hendrik Böttger, Yoshitaka Yoda, Makina Saito, Shinji Kitao, Yasuhiro Kobayashi, Makoto Seto, Kenji Tamasaku, John D. Lipscomb*, Kiyoung Park*, and Edward I. Solomon*, Nuclear Resonance Vibrational Spectroscopic Definition of the Fe(IV)2 Intermediate Q in Methane Monooxygenase and Its Reactivity, J. Am. Chem. Soc. 2021
DOI: 10.1021/jacs.1c05436
https://pubs.acs.org/doi/10.1021/jacs.1c05436