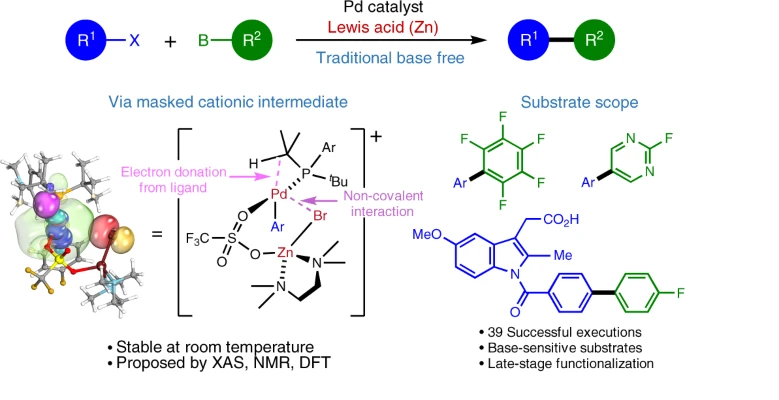
Pd催化有机卤化物与有机硼化物之间的Suzuki-Miyaura交叉偶联反应是构建C-C化学键的可靠方法,这个反应过程通过碱进行转金属化,但是当反应体系中含有碱导致竞争性的氢脱硼化反应的反应速率增加。
有鉴于此,东京医科齿科大学Takashi Niwa、大阪大学Yuta Uetake等报道通过Lewis酸辅助进行转金属化反应中间步骤,实现了有机Pd(II)中间体与有机硼之间的转金属化。通过实验和理论计算研究,发现无需碱的作用能够在加热条件中实现可控的转金属化,改善了Suzuki-Miyaura反应的兼容性。
参考文献
Niwa, T., Uetake, Y., Isoda, M. et al. Lewis acid-mediated Suzuki–Miyaura cross-coupling reaction. Nat Catal 4, 1080–1088 (2021).
DOI: 10.1038/s41929-021-00719-6