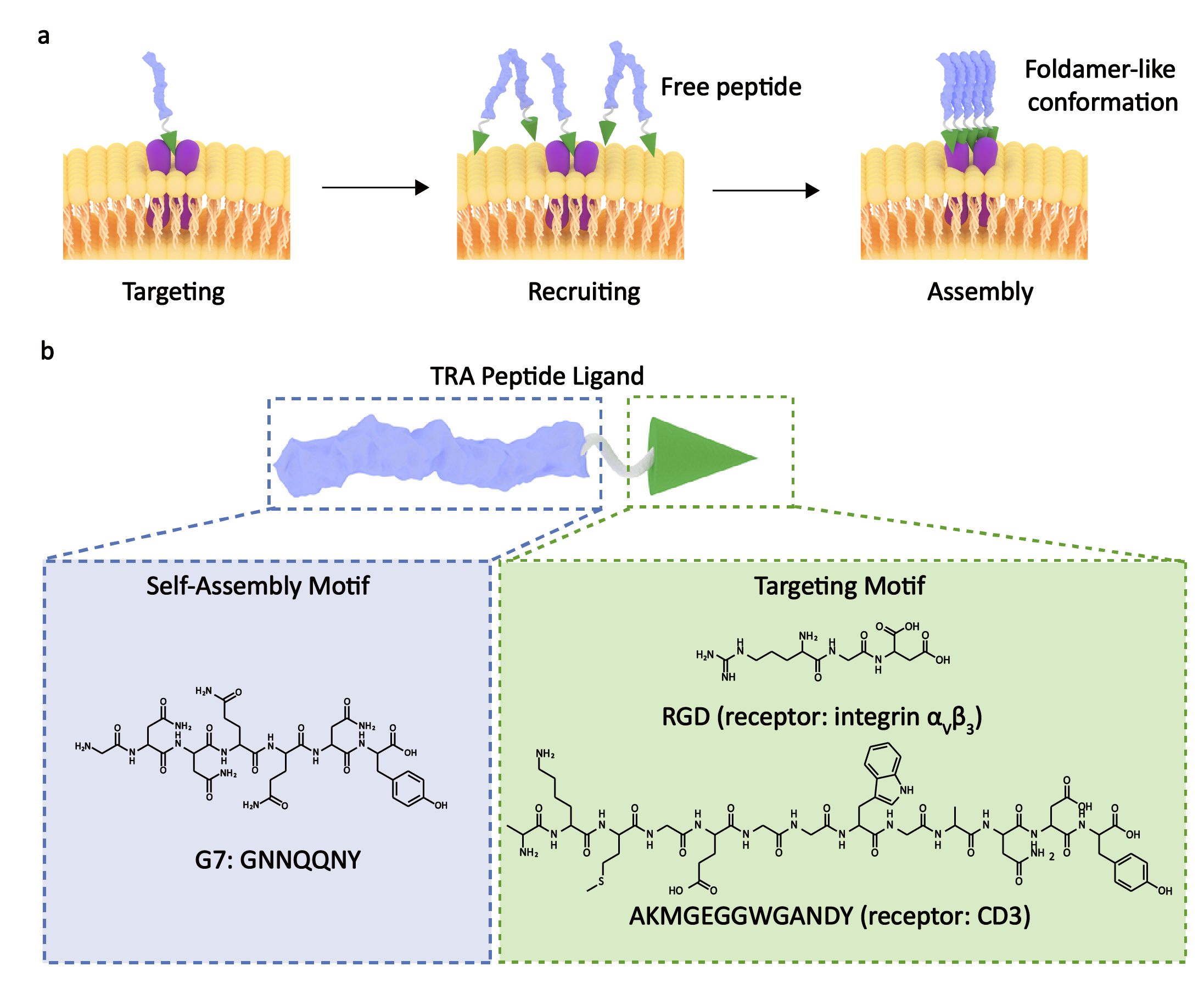
如何精确、有效地调控蛋白质功能是一项巨大的研究挑战。国家纳米科学中心王浩研究员构建了一种可编程的肽分子,其由靶向和自组装模块组成,能够实现由靶向受体蛋白控制的特异性高效组装。
本文要点:
(1)与细胞膜受体结合后,肽构象会随着自组装活化能降低而趋于稳定,以促进肽-蛋白复合物的齐聚。随后,实验设计了一个能够识别整合素αVβ3受体的GNNQQNY-RGD多肽(G7-RGD),以用于概念验证研究。
(2)在αVβ3蛋白存在的情况下,游离G7-RGD的临界聚集浓度会从525 µM下降到33 µM,并且生成的G7-RGD簇体能够驱动整合素受体的齐聚。与此同时,实验也设计了一种双特异性组装肽antiCD3-G7-RGD以用于癌症免疫治疗,并证明其能够实现CD3齐聚和T细胞活化,进而实现由T细胞介导的癌细胞溶解。
Man-Di Wang. et al. In Situ Self-Assembly of Bispecific Peptide for Cancer Immunotherapy. Angewandte Chemie International Edition. 2022
DOI: 10.1002/anie.202113649
https://onlinelibrary.wiley.com/doi/10.1002/anie.202113649



















