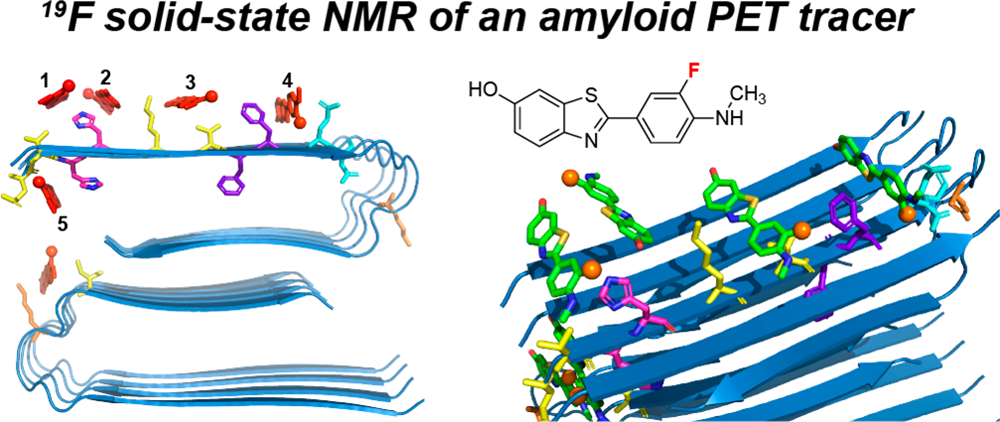
利用正电子发射断层扫描(PET)技术对淀粉样蛋白进行成像是诊断阿尔茨海默病等神经退行性疾病的重要方法之一。其中,很多11C和18F标记的PET示踪剂往往对靶蛋白具有不同的结合能力、特异性和亲和力。然而,研究者对于这些差异的结构基础还了解甚少。麻省理工学院Mei Hong和卫奇塔州立大学Haifan Wu利用19F和13C固体核磁共振对PET显像剂flutemetamol和阿尔茨海默氏β-淀粉样肽(Aβ40)的结合位点进行了研究。
本文要点:
(1)高效液相色谱和19F NMR谱表明,flutemetamol以化学计量比为每4到5个多肽结合一个配体的方式结合Aβ40纤维多形体。其中,一半的配体为紧密结合,而另一半则为松散结合。13C和15N的化学位移表明,该Aβ40多形体有一个固定的N端,一个非β折叠His14和一个非β折叠C端。实验通过19F−13C和19F−1H旋转-回声双共振(REDOR)实验测量了配体氟与肽残基的接近程度。
(2)光谱结果显示,多肽中的肽段12VHH14、18VFF20和39VV40距离配体最近。REDOR对接模拟结果表明,这三个片段可形成多个结合位点。并且在不同的Aβ多态性中,这些位点上的配体取向和位置是相似的。实验进一步将Aβ40中的flutemetamol相互作用残基与其他淀粉样蛋白中的小分子结合位点进行比较后发现,共轭芳香化合物会优先结合由芳香残基、极性残基和带电残基排列的β折叠表面沟槽,而这一发现也可以解释不同PET示踪剂对于不同淀粉样蛋白的特异性。
Pu Duan. et al. Binding Sites of a Positron Emission Tomography Imaging Agent in Alzheimer’s β‑Amyloid Fibrils Studied Using 19F Solid-State NMR. Journal of the American Chemical Society. 2022
DOI: 10.1021/jacs.1c12056
https://pubs.acs.org/doi/10.1021/jacs.1c12056



















