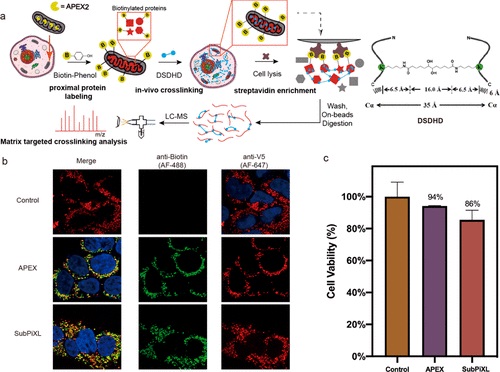
识别细胞的亚细胞生态位中蛋白质复合物的结构对于了解其不同功能是必要的。基于此,中国科学院大连化学物理研究所赵群和张丽华等人开发了一种亚细胞器蛋白质组标记辅助体内交联 (SubPiXL) 策略来识别活细胞中的区域蛋白质构象和相互作用。
本文要点:
(1)由于线粒体的功能重要性和明确的区室划分,确定了位于线粒体基质中蛋白质复合物的特定构象和相互作用组。与常用的细胞器分离方法和完整的线粒体交联方法相比,该方法对细胞器的亚区室进行了更精细的空间表征。此外,这种方法避免了细胞器分离过程中的交叉污染和细胞微环境破坏。因此,作者实现了 73% 的线粒体选择性和 98% 的已知亚细胞器注释对线粒体基质和可接近内膜的特异性。
(2)同时,捕获了更多具有高动态的蛋白质-蛋白质相互作用 (PPI),导致在 1/11 的时间内 PPI 识别数量增加了 1.67 倍。在这些结构交联及相互作用组和构象的具体表征的基础上,描绘了线粒体基质中靶向的结构动力学。然后澄清了具有多亚细胞定位的蛋白质的线粒体基质限制信息。总之,SubPiXL 是一种很有前途的技术,用于研究亚细胞器分辨的蛋白质构象和相互作用分析,有助于更好地理解结构衍生功能。
参考文献:
Yuxin An, Qun Zhao, Zhou Gong, Lili Zhao, Yi Li, Zhen Liang, Peng Zou, Yukui Zhang, and Lihua Zhang. Suborganelle-Specific Protein Complex Analysis Enabled by in Vivo Cross-Linking Coupled with Proximal Labeling. Anal. Chem. 2022
DOI:10.1021/acs.analchem.2c01637
https://doi.org/10.1021/acs.analchem.2c01637



















