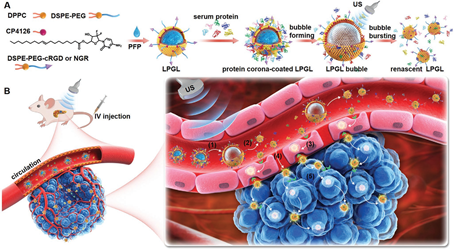
配体/受体介导的靶向药物递送是提高纳米药物临床疗效的一种重要策略,但其效果也会因血浆蛋白在纳颗粒表面结合形成蛋白冠而被减弱。研究表明,超声空化可以通过超声(US)诱导脂质体重组来解开脂质体纳米颗粒上的血浆蛋白冠。为了证明该方法的可行性和有效性,浙江大学黄品同教授、申有青教授和周珠贤教授开发了负载吉西他滨(GEM)和全氟戊烷(PFP)、靶向肽修饰的可重构脂质体(LPGLs),以用于癌症靶向治疗。
本文要点:
(1)在血液循环中,靶向肽会被血浆蛋白冠所灭活,进而失去靶向能力。当LPGLs到达肿瘤血管后,超声照射会诱导其通过液-气相变以从纳米液滴转变为微气泡,并通过脂膜重组剥离表面的蛋白冠。
(2)实验结果表明,激活的脂质体会重新获得识别肿瘤新生血管上受体的能力,进而启动配体/受体介导的转胞作用,以实现高效的肿瘤聚集和穿透,并在患者源性肿瘤移植的多种肿瘤模型中产生强大的抗肿瘤活性。综上所述,该研究设计了能够解决蛋白冠的流体生物障碍的有效策略,可用于开发靶向脂质体以实现主动的肿瘤内运输和有效的癌症治疗。
Guowei Wang. et al. Unraveling the Plasma Protein Corona by Ultrasonic Cavitation Augments Active-Transporting of Liposome in Solid Tumor. Advanced Materials. 2022
DOI: 10.1002/adma.202207271
https://onlinelibrary.wiley.com/doi/10.1002/adma.202207271



















