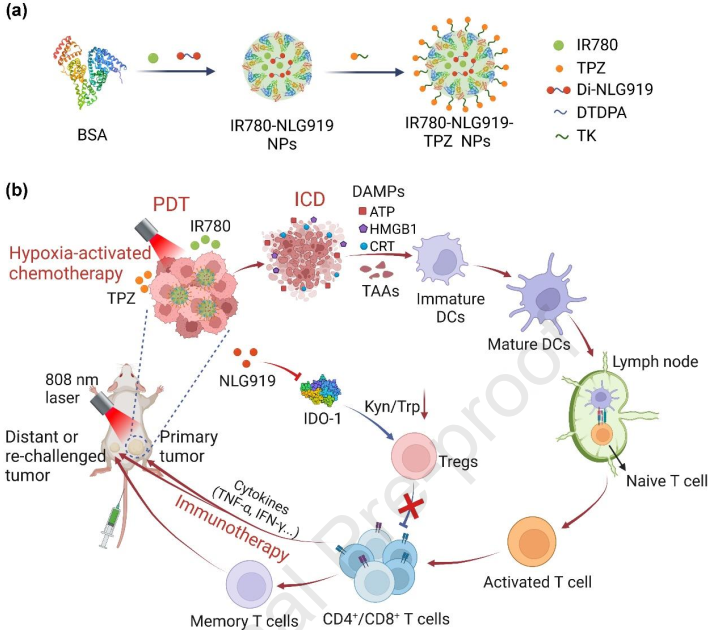
乏氧的肿瘤微环境(TME)会严重限制光动力治疗(PDT)的疗效。此外,免疫抑制性TME和诱导免疫原性细胞死亡(ICD)不足等问题也会使PDT引起的抗肿瘤免疫效果受到影响。为了同时解决这些关键问题,苏州大学丁大伟教授构建了一种基于白蛋白的纳米平台,并将其用于共递送IR780,NLG919二聚体和作为双重增强因子的乏氧激活前药替拉帕胺(TPZ)以实现癌症协同治疗。
本文要点:
(1)在近红外光照射下,IR780能够产生1O2以实现PDT和同时裂解对ROS敏感的连接子,从而触发TPZ的释放,并通过加重肿瘤乏氧激活其化疗性能。该研究首次发现,TPZ介导的化疗可促进PDT诱导的肿瘤ICD,进而引起更强的抗肿瘤免疫,例如产生肿瘤特异性细胞毒性T淋巴细胞(CTL)。
(2)此外,瘤内丰富的GSH也会触发NLG919的激活,进而通过特异性抑制吲哚胺2,3-双加氧酶1(IDO-1)来减轻免疫抑制性TME,促进肿瘤内CTL的浸润和对原发性及远端肿瘤的抑制。此外,产生的记忆T细胞也可以几乎100%抑制肿瘤的复发和转移。综上所述,该研究开发的纳米平台能够为利用乏氧激活的化疗实现对乳腺癌进行光动力-免疫治疗的双重增强提供新的范例,并为治疗其他乏氧和免疫抑制的恶性肿瘤奠定坚实的基础。
Mengyuan Wang. et al. Controllable hypoxia-activated chemotherapy as a dual enhancer for synergistic cancer photodynamic immunotherapy. Biomaterials. 2023
https://www.sciencedirect.com/science/article/pii/S014296122300265X



















