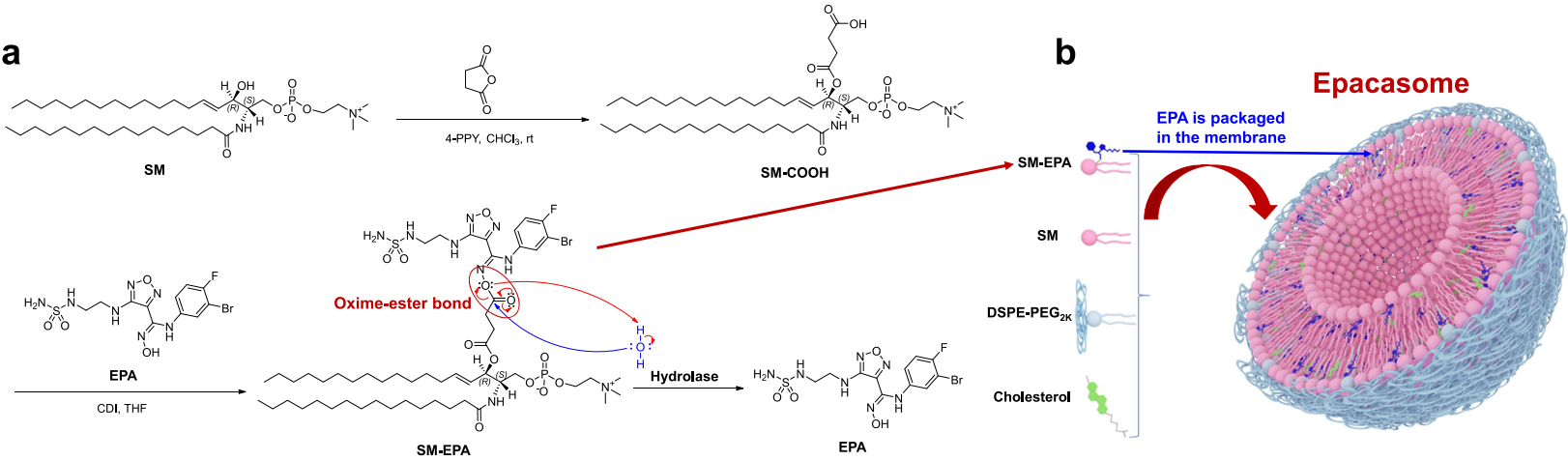
IDO1抑制剂艾卡哚司他(EPA)联合PD-1检查点抑制剂的治疗策略在最近的转移性黑色素瘤III期临床实验中失败。有鉴于此,亚利桑那大学Jianqin Lu通过对水解酶裂解高度响应的肟-酯键将EPA化学连接到鞘磷脂上,开发了一种EPA纳米囊泡治疗平台(Epacasome)。
本文要点:
(1)与游离的EPA相比,Epacasome可通过网格蛋白介导的内吞作用表现出更高的细胞摄取,并增强对IDO1的抑制和T细胞增殖。此外,Epacasome也具有显著改善的药代动力学和肿瘤富集性能,可实现有效的肿瘤内药物释放和肿瘤深部穿透。研究发现,Epacasome的抗癌效果也优于游离的EPA。在雌性小鼠B16-F10黑色素瘤模型中,Epacasome可通过增强细胞毒性T淋巴细胞(CTL)和降低调节性T细胞和髓源性抑制细胞应答来增强PD-1阻断。
(2)共包裹免疫原性达卡巴嗪后,Epacasome能够联合PD-1抑制剂上调NKG2D介导的CTL和自然杀伤细胞应答,以进一步增强抗肿瘤效应和免疫应答。在临床相关的雌性小鼠术后黑色素瘤模型中,该联合治疗策略可有效预防肿瘤复发,并延长小鼠生存期。综上所述,该研究构建的Epacasome具有与PD-1阻断相协同以改善黑色素瘤免疫治疗应答的重要潜力。
Zhiren Wang. et al. Sphingomyelin-derived nanovesicles for the delivery of the IDO1 inhibitor epacadostat enhance metastatic and post-surgical melanoma immunotherapy. Nature Communications. 2023
https://www.nature.com/articles/s41467-023-43079-4



















