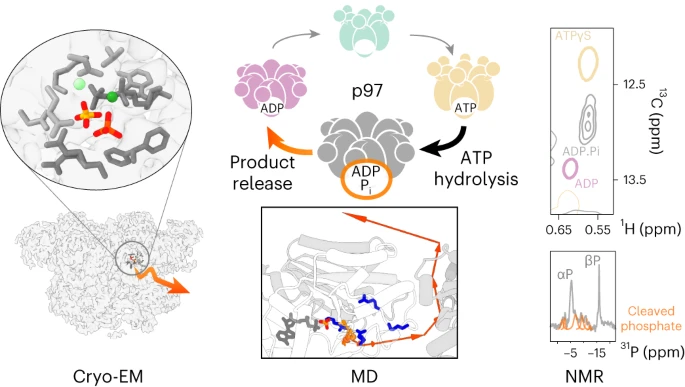
人类酶p97通过以ATP依赖的方式展开数百种蛋白质底物来调节各种细胞途径,使其成为蛋白质稳态的重要组成部分和有影响力的药理学靶点。六聚体复合物在其整个催化循环中经历显著的构象变化。有鉴于此,慕尼黑大学Anne K. Schütz、哥廷根大学Eri Sakata、慕尼黑工业大学Martin Zacharias、Manuel Hitzenberger等通过合并冷冻电镜、核磁共振波谱和分子动力学模拟,弄清ATP水解前后的活性位点附近的分子运动情况。
参考文献
Shein, M., Hitzenberger, M., Cheng, T.C. et al. Characterizing ATP processing by the AAA+ protein p97 at the atomic level. Nat. Chem. (2024)
DOI: 10.1038/s41557-024-01440-0