四川大学郭俊凌教授课题组联合第四军医大学杨国栋教授、首都医科大学江青松教授课题组利用层层自组装LbL技术,将siRNA-CTSK修饰的纳米金粒子通过生物基高分子材料组装到钛植体表面,构建分级纳米结构涂层,该图层能够缓释siRNA-CTSK至种植体周围单核细胞,抑制其破骨分化,同时改变细胞分泌特征,协同促进钛植体周围骨骼和血管组织再生,为骨修复的先进基因治疗提出了重要理论基础。相关成果在生物医学材料顶级期刊Biomaterials报道。

研究内容简介:
随着高强度体育活动更加流行和人口老龄化加剧,大大增加了肌肉及骨骼创伤的发生率。在全球范围内,与骨创伤相关医疗和社会经济成本也在急剧上升。以美国为例,每年总共进行超过100万的髋和膝关节置换手术,其费用超过250亿美元。骨植入物工程技术已经发展成为克服与传统使用的自体移植物和同种异体移植物相关的严重缺点的潜在替代方法。然而,尽管骨折和关节置换术的外科治疗中,当前护理标准的成功率超过90%,但仍然存在10%的失败,因此需要迫切开发新的先进骨植入物技术进一步降低这部分具有挑战的临床情况,例如糖尿病患者和更年期女性患者。
骨植入物的表面功能化是增强骨整合的重要手段,包括增加材料表面亲水性,包裹骨祖细胞或释放生物分子(生长因子,细胞因子,核酸等)的方法。间充质干细胞(MSCs)的成骨功能增强是一个重点目标,已被视为具有显著优势的治疗目标。通过siRNA的治疗方法已取得了显着进展,以增强MSC的成骨功能,这表明siRNA的递送可用于促进MSC的有效分化。尽管前期的工作已致力于证明通过骨植入物涂层进行局部siRNA递送的可行性,但大多数只集中于MSC活性的调节,并且骨组织内部功能性血管系统的再生仍然难以实现。需要强调的是,骨再生中血液的运输对于骨损伤的治疗具有极其重要的意义。
因此,通过高度精确的基因沉默过程以增强血管再生,可以大大提高骨植入物的成功率。综上所述,开发一种新型的siRNA递送治疗性植入物涂层,可以实现血管重建和骨再生的协同目标。
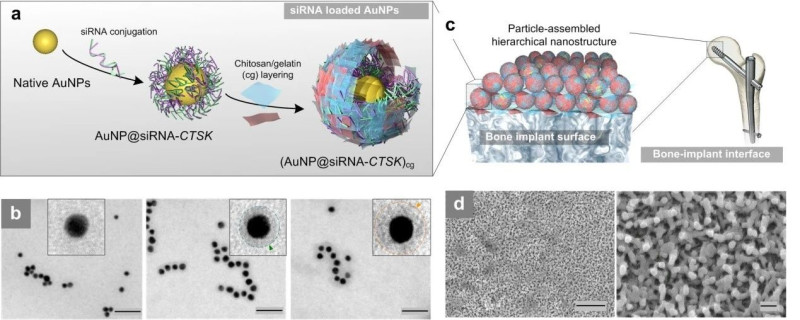
图1.基于高生物相容性自组装涂层的siRNA-纳米颗粒形成分级纳米结构种植体涂层
由于超结构可以显着增强生物材料界面上的相互作用,因此将颗粒组装成多层级结构受到越来越多的研究关注。近年来由郭俊凌教授和墨尔本大学Frank Caruso院士报道了一种基于天然高分子的颗粒超结构组装方法(NatureNanotech. 2016, 11, 1105; Science 2018, 362, 813),该方法展现了模块化的优势以及优秀的生物相容性。因此,在该研究中,我们采用另外两种天然高分子,具有抗菌活性的壳聚糖和明胶,构建了多层级纳米涂层。siRNA-金纳米颗粒(AuNPs)被组装在钛植入物上,合成了具有超结构的多层结构(图1)。
这种分层结构为植入物提供了独特的多尺度形貌,从而增加了润湿性和粗糙度,促进siRNA与生物组织界面的联系。组织蛋白酶K(CTSK)是一种溶酶体半胱氨酸蛋白酶,通常参与骨骼重塑和吸收。通过设计的siRNA-CTSK抑制CTSK,不仅可以增加破骨细胞的数量,而且还可以刺激骨血管系统的血管生成,从而实现高度精确的基因沉默过程。
在研究中该团队发现与siRNA-CTSK结合的生物活性纳米颗粒的超结构协同促进了七个不同的生长因子释放(图2)。基于微芯片的实验表明,植入物涂层可以通过有效的细胞内递送到周围的巨噬细胞中来显着增强骨骼再生过程。通过调节mRNA表达,显着促进了成骨相关基因的表达。更重要的是,涉及关键血管再生因子的协同血管生成反应也得到了显着增强,这是骨血管系统再生的关键标准。
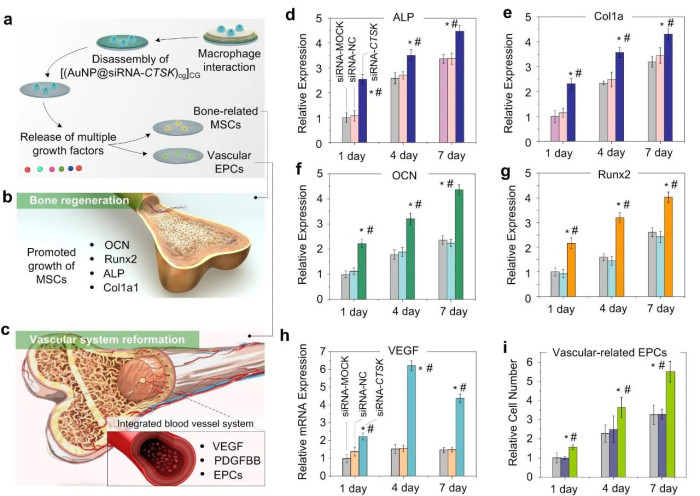
图2.纳米结构多层级涂层的生物相容性以及多功能siRNA-CTSK在体外和体内向周围组织的有效传递。
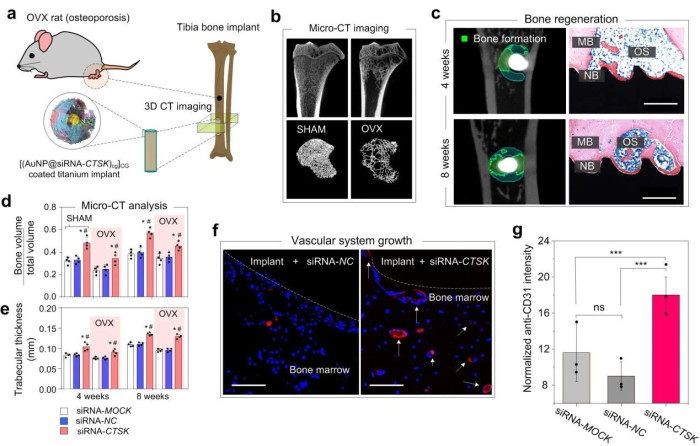
图3.纳米涂层钛植入物对骨质疏松大鼠模型的体内综合治疗。
此基础上,利用卵巢切除(OVX)大鼠等动物模型,证实了课题组创建的纳米图层能够有效干预种植体周围破骨(前体)细胞CTSK表达,改变细胞旁分泌组分,进而协同促进血管再生和骨再生(图3)。区别于传统之间增强间充质细胞成骨功能或抑制破骨细胞的破骨功能,本研究以破骨细胞及其前体细胞的分泌功能为靶点;此外,本研究通过在种植体表面进行纳米颗粒图层改构,实现局部高效、特异地靶向递送,避免了系统性的毒副作用。上述研究靶点和递药策略的创新,为再生医学的发展提供了一个新思路。
首都医科大学邢鹤琳为文章的第一作者,山西医科大学王兴为文章的共同第一作者,首都医科大学江青松教授,第四军医大学杨国栋教授,四川大学郭俊凌教授为文章的共同通讯作者。特别感谢国家自然科学基金、四川大学“双一流”项目基金等给予的资助和支持。
课题组简介:
四川大学郭俊凌教授:墨尔本大学化学与分子生物学博士,哈佛大学博士后,国家特聘青年专家,四川大学“双百人”海外高层次引进特聘教授,博士生导师。曾任职于美国哈佛大学顶尖Wyss仿生工程研究中心,于墨尔本大学国际著名材料化学家FrankCaruso教授(英国皇家科学院院士,澳大利亚科学院、工程院双院院士)课题组获博士学位。哈佛大学期间于SamirMitragotri教授(美国工程院、美国医学院双院院士)课题组开展研究。郭俊凌教授在MPN以及植物多酚化学及材料学领域具有广泛国际声誉,近年来,课题组相关研究以第一或通讯作者在Science《科学》、Nature Nanotechnology《自然-纳米技术》、Energy & Environmental Sciences《能源与环境科学》、Angewandte Chemie《德国应用化学》等国际顶级期刊上发表,并被多家国际著名新闻媒体报道,包括Eurek!、Harvard Gazette、ChemviewsMagazine、Phy.org、德国之音等,同时多项突破性研究也被F1000评为领域重大研究,被Nature Nanotechnology、Nature Biotechnology、Nano Today等学科顶级杂志选为特别专题与研究热点。
第四军医大学杨国栋教授:第四军医大学特聘研究员,空军高层次人才,硕士生导师。主要从事基因表达调控及靶向干预策略研究,先后主持国家自然科学基金3项、陕西省自然科学基金1项。在寻找疾病相关RNA代谢异常的药物靶标、优化核酸药物的加载与缓释系统、创建基因药物靶向递送策略和疗效评价等方面,取得系列进展。获国家发明专利2项,以第一或通讯作者在Gastroenterology、Nano Letters、Biomaterials、Theranostics、J Controlled Release、Mol Ther-Nucl Acids等国际知名杂志发表SCI收录论文30余篇。
首都医科大学江青松教授:主任医师,教授,博士研究生导师。中华口腔医学会第七届口腔修复学专业委员会副主任委员。2006-2008 年负责完成北京市自然科学基金课题《咬合支持丧失对老年人认知功能影响的初步研究》,2008-2012年负责完成国家自然科学基金课题《咬合支持丧失对认知功能损害发生发展的影响及干预研究》,2014-2017年负责完成国家自然科学基金面上项目《咬合支持丧失对伴有慢性脑缺血的认知功能损害的影响及机制研究》,2018年负责国家自然科学基金面上项目《咬合支持丧失通过胶质细胞网促进认知神经元退变的作用机制研究》。以第一作者和通讯作者在口腔领域和相关医学领域杂志Archives of Oral Biology、J Adhes Dent.、Behav Brain Res、Mol Biol Rep等发表多篇论文。











