均相催化在催化工业中占有举足轻重地位,尤其是对于一些多官能团构建,空间结构复杂,选择性要求较高的反应过程。经过近两个世纪的发展,均相催化已然取得了丰硕成果。近年来,均相催化的发展主要包括从贵金属催化剂向非贵金属催化剂拓展,从过渡金属催化剂向主族元素催化剂发展,以及多官能团,(空间)结构复杂产物的合成等。近期,国外多个均相催化大牛课题组在相关研究发现取得新的研究进展,相关研究相继在Science和Nature Chemistry发表。
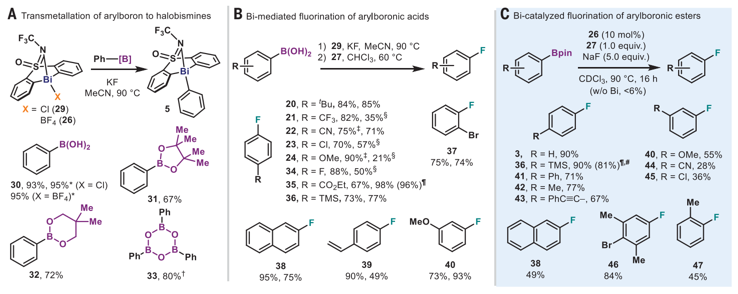
1. Science:德国马克思普朗克研究所报道铋催化芳基硼酸酯氟化反应均相过渡金属催化反应在有机合成中具有重要应用,实现了多种有机快速转化反应。在这些反应中,过渡金属的氧化/还原循环过程是催化反应得以发生的重要原因。贵金属在这些催化反应中应用广泛,并起到非常好的反应活性,为了在实际生产生活中应用,利用分布广、价格更合适的过渡金属(Fe,Ni,Co,Cu,Mn,Cr等)有巨大意义。此外,一些位于主族金属却具有过渡金属类似活性的金属同样得以发展(Main-group elements as transition metals,Nature 463, 171–177 (2010).; Frontiers in molecular p-block chemistry: From structure to reactivity, Science 363, 479–484 (2019). )。由于硼、磷具有特殊的酸性(frustrated Lewis pair(FLP)),因此在过渡金属催化上体现出不同的催化效果。通过这些发现,人们发展了一些和以往不同的催化体系。铋金属,作为主族元素催化剂,通过其Lewis酸性,能够起到有机催化反应(C-H键活化反应(Angew. Chem. Int. Ed. 2018, 57, 3825–3829.)、羰基化反应(Chem. Sci. 2019, 10, 4169–4176.)、转移氢化反应(J. Am. Chem. Soc. 2019, 141, 4235–4240.)、自由基反应(Angew. Chem. Int. Ed. 2019, 58, 12924–12929)等)。马克思普朗克研究所Josep Cornella报道了利用铋的Bi3+/Bi5+循环用于芳基硼酸酯的氟化反应。通过解析中间体的晶体和其他控制实验对催化反应的机理进行了研究,给出了反应机理。(1)设计了一种Bi(III)复合物,由一种多芳基束缚骨架配体(tethered backbone ligand)和砜官能团构成。对反应机理和重要反应中间体进行了研究。机理研究中氟化试剂应用XeF2。通过Bi(III)和XeF2在CDCl3中和0 oC反应,通过氧化反应,不稳定的Bi(III)骨架结构被XeF2氧化,生成两个Bi-F化学键得到Bi(IV)。解析了Bi(III)复合物的结构。通过这个反应对反应动力学进行了详细研究。(2)在实验中,利用KF或NaF作为氟化试剂,芳基硼酸酯作为反应物,在60或90 oC条件下进行反应,溶剂选择MeCN或CHCl3。对芳基底物进行了拓展,发现烯烃、甲氧基、卤代基都有很好的兼容性和较高的收率(~90 %)。不同的硼酸酯有变化的收率,未酯化的硼酸有最好的收率,BPin酯化的硼酸酯收率有降低。芳环的立体位阻对反应产率有较大影响,邻位甲基的产率明显降低,萘产率也明显降低。Oriol Planas, Feng Wang, Markus Leutzsch, Josep Cornella*. Fluorination of arylboronic esters enabled by bismuth redox catalysis. Science, 2020, 367, 313–317.
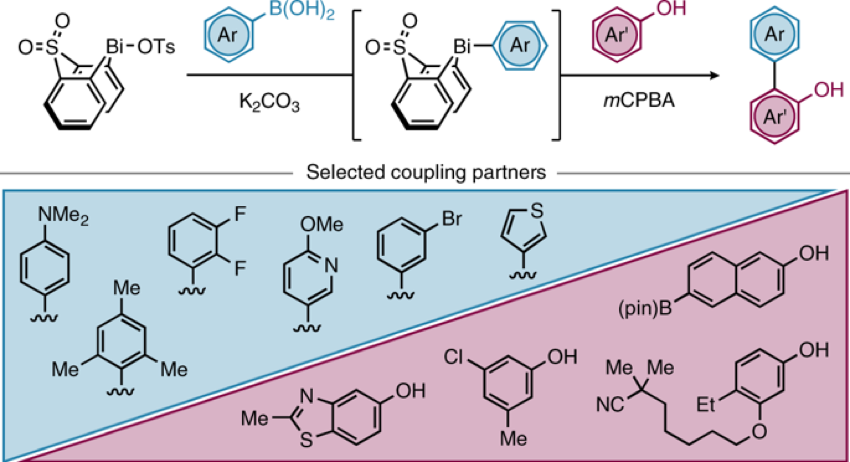
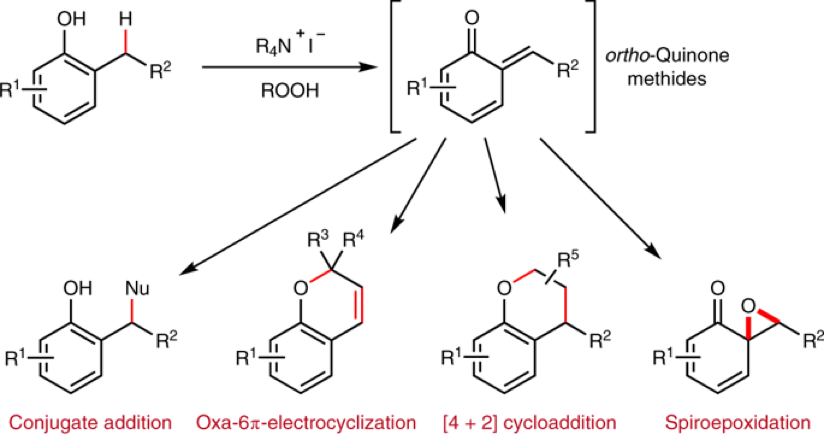
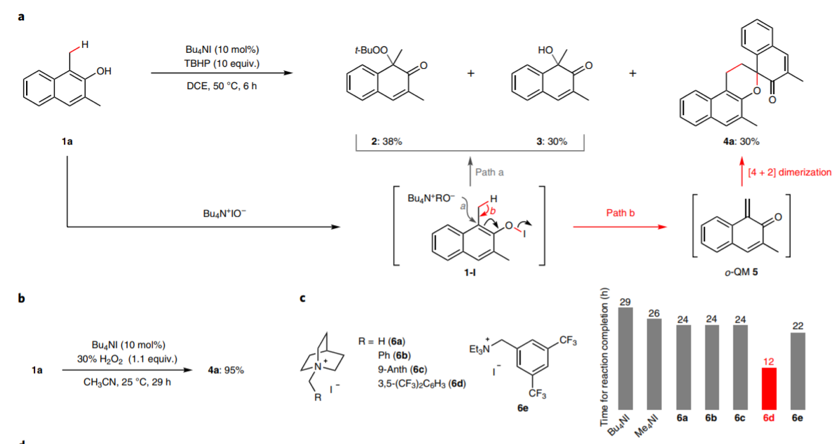
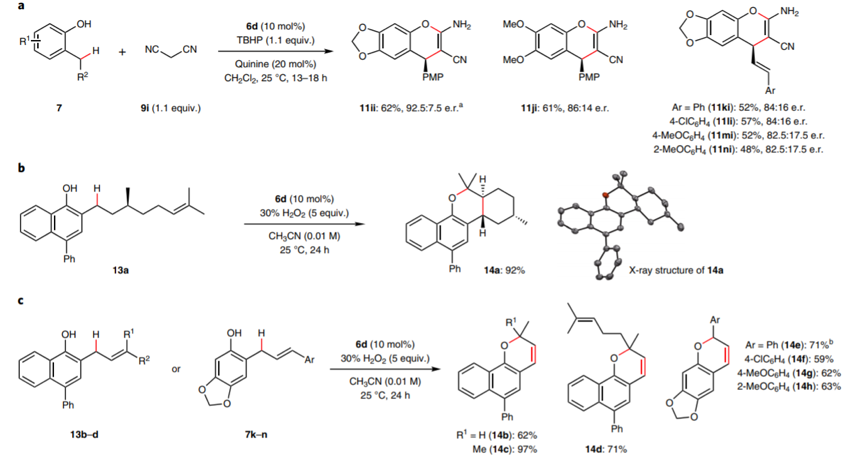
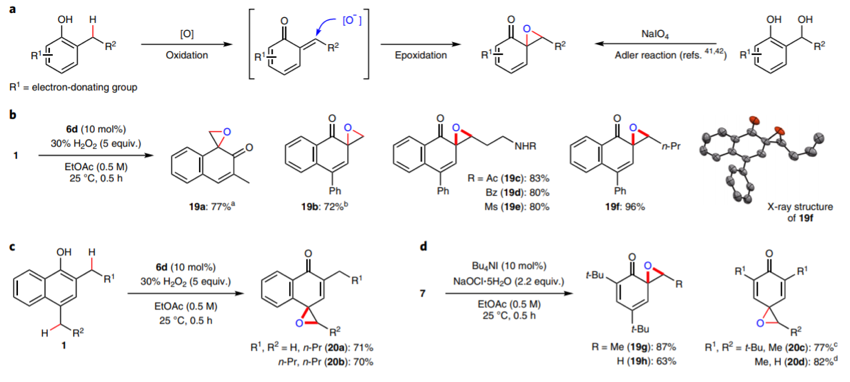
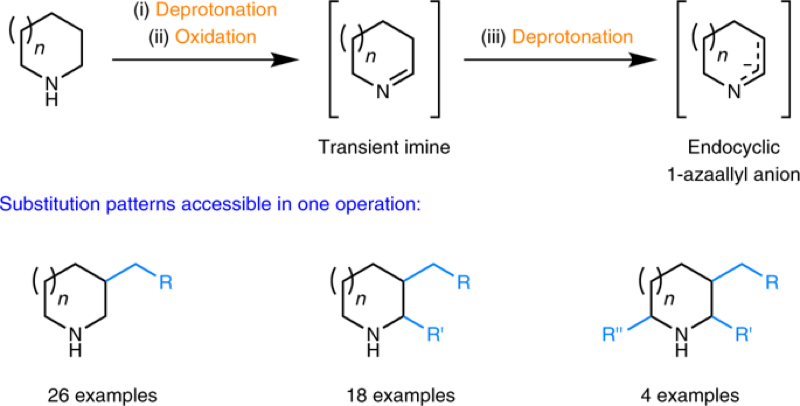
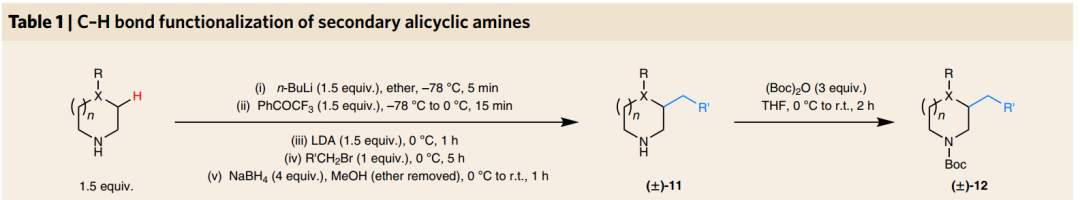
DOI: 10.1126/science.aaz2258https://science.sciencemag.org/content/367/6475/3132. Nature Chemistry: 英国诺丁汉大学Liam T. Ball等报道2-羟基双芳基类分子的合成2-羟基双芳基在有机化学,药物化学,材料化学中都有比较广泛的应用,因此这类型分子的合成非常重要。英国诺丁汉大学的Liam T. Ball等发展了应用范围比较广泛的合成方法,通过使用硼酸对酚、萘酚的邻位进行修饰。该反应中主要过程是通过大量易得的Bi(III)与芳基硼酸反应,原位氧化脱硼酸基团生成Bi(V)芳基试剂进行的。(1) 在温和的反应条件下,通过芳基(杂芳基)和酚(萘酚)进行偶联反应,得到多种多样的有机分子。(2) 该反应过程中Bi(III)物种能够在多次反应中循环使用。Jurrat, M., Maggi, L., Lewis, W. et al. Modular bismacycles for the selective C–H arylation of phenols and naphthols. Nat. Chem. 12, 260–269 (2020). DOI: 10.1038/s41557-020-0425-4https://www.nature.com/articles/s41557-020-0425-43. Nature Chemistry: 日本名古屋大学报道邻位醌甲基化物中间体的反应性邻位醌有机物(Ortho-Quinone methides, o-QMs)在有机合成领域中是重要的中间体,由于分子由电中性的非芳环结构和两性离子(zwitterionic)芳环结构组成,这种分子具有独特的化学反应性。o-QM在一些关键生物体反应中起到重要作用。自从2000年左右,这种o-QM分子逐渐在有机反应中起到越来越重要的作用([4+2]环加成反应,电环化反应,共轭加成,螺环氧化),该反应通常以取代的苄基分子在酸或碱催化作用,经过酚的氧化过程得到。此外,该反应中间体可以通过仿生方法经由邻位烷基苯酚在金属氧化剂或过渡金属复合物作用下进行氧化反应进行。日本名古屋大学的Ishihara Kazuaki 最近发明了使用TBHP作为氧化剂和偶联试剂用于苯酚的高碘化合物(hypoiodite)催化的反应,该反应通过苯酚的氧化去芳化过程进行(Heterocycles, 2017, 95, 1132–1147)。日本名古屋大学的Ishihara Kazuaki等发表了一种不用过渡金属氧化剂,将邻位烷基苯酚转化为邻位醌有机物的方法。这种方法实现了比较好的选择性,在各种多组分反应中(比如[4+2]环加成反应,电环化反应,共轭加成,螺环氧化)展现比较好的反应性。(1)反应实施和条件筛选。通过对反应条件的筛选,实现调控生成的醌类产物。通常条件中,在酸性或碱性条件进行β消除反应生成o-QM产物。作者使用R4I催化剂和H2O2/ROOH(原位生成R4N+IO-物种),实现了三组分反应。[4+2]级联氧化加成。作者使用萘酚或苯酚和5倍、50倍的乙基乙烯基醚反应,加入10 mol %的催化剂,1.1倍氧化剂。在25 ℃中反应,反应能够以[4+2]成环过程反应,收率能达到中等到较高收率。苯酚和1.1倍的丙二氰同样能够实现[4+2]氧化环合反应。作者发现对6种底物都有中等收率,并且反应产物体现一定的手性。对于萘酚分子中具有烯烃官能团的烷基取代基能够实现分子内的[4+2]环化反应,反应以中等到高收率进行。作者对苯酚和丁二酰亚胺之间的氧化反应进行了探索。该反应能够对酚羟基邻位甲基上的C-H碱活化,并加成丁亚酰亚胺。苯酚羟基对位上甲基的C-H键同样能够经由此过程氧化加成酰亚胺官能团或其他亲核官能团。苯酚上邻位或对位上的C-H键活化后,能够和氧化剂(H2O2或NaIO4)反应,在α-C位点上通过氧化反应,生成环氧官能团。(2)总之,作者通过过氧化物氧化剂生成o-QM醌类中间体,并在各种亲核试剂作用,实现了无金属催化的各种官能团化反应([4+2]成环反应、氧杂-6π-电环化反应、和O、N亲核试剂的共轭加成反应、螺环氧化反应)。Muhammet Uyanik; Kohei Nishioka; Ryutaro Kondo; Kazuaki Ishihara*. Chemoselective oxidative generation of ortho -quinone methides and tandem transformations. Nat. Chem. 2020.DOI: 10.1038/s41557-020-0433-4https://www.nature.com/articles/s41557-020-0433-44. Nature Chemistry: 佛罗里达大学Daniel Seidel报道环状二级胺一锅法实现三官能团化具有生物活性的环状烷基胺的合成通常需要经由多步反应,并且需要在反应中加入并脱除保护基,一些研究中实现了对这种过程的简化,比如通过C-H键活化对有机胺进行活化,但是对未保护的胺进行修饰多个官能团,目前为止还没有相关可行方法。佛罗里达大学Daniel Seidel等发现了一种方法实现同时对环状二级有机胺的三官能团取代反应。在该方法中,分子首先经过锂化与酮氧化剂作用,生成瞬态亚胺物种,随后转化为环内1-氮杂烯丙基阴离子(endocyclic 1-azaallyl anion)。这个瞬态亚胺物种随后可以生成β取代,α、β双取代,α、β、α’三取代产物。本方法中特别重要的是原位生成环内1-氮杂烯丙基阴离子中间体物种。(1)二级环状胺的β官能团化。1.5倍二级环状胺分子和1.5倍n-BuLi在乙醚中于-78 ℃中反应5 min,随后加入1.5倍PhCOCF3,于15 min升温到0 ℃。在0 ℃中加入1.5倍LDA还原剂反应1 h,随后加入1倍溴化物反应5 h。加入4倍NaBH4和MeOH,升温至室温,反应1 h,得到β位取代的环状胺分子。通过加入3倍量的(Boc)2O,实现将二级N上的N-H键保护。该反应对多种苄基溴物种有兼容性(甲基、氰基、氟、甲氧基、氧杂环、酯基、双键),一般能得到中等收率。(2)二级环状胺的α,β双官能团化。1.5倍二级环状胺分子和1.5倍n-BuLi在乙醚中于-78 ℃中反应5 min,随后加入1.5倍PhCOCF3,于15 min升温到0 ℃。在0 ℃中加入1.5倍LDA还原剂反应1 h,随后加入1倍溴化物反应5 h。加入3.5倍携带官能团的有机锂试剂降温至-78 ℃反应2 h,升温至室温,得到α,β位双取代的环状胺分子。产物一般为中等收率,并且具有一定的d.r.构型选择性。(3)二级环状胺的α,β,α’三官能团化。在二级环状胺的α,β双官能团化反应后,降温至-78 ℃,加入2.5倍PhCOCF3并反应5 min,随后加入3.5倍携带官能团的有机锂试剂反应2 h,升温至室温,得到α,β,α’三官能团化的产物分子,展现了低至中等收率。Weijie Chen; Anirudra Paul; Khalil A. Abboud; Daniel Seidel*. Rapid functionalization of multiple C–H bonds in unprotected alicyclic aminesDOI: 10.1038/s41557-020-0438-zhttps://www.nature.com/articles/s41557-020-0438-z