
片岡一則 (Kazunori Kataoka),博士,日本东京大学教授、美国国家工程院外籍院士(NAE)、美国国家发明家科学院院士(NAI Fellow)、国际控制释放协会(Controlled ReleaseSociety, CRS)前主席、日本高分子学会前主席;ACS Nano、Biomaterials、Biomacromolecules等杂志副主编。
Kataoka教授的研究主要集中于聚氨基酸生物可降解高分子材料在基因递送、药物靶向传输、以及分子影像方面的应用基础及临床转化研究。是国际纳米生物医学领域的先驱,目前已有5个纳米药物在美国、日本等国进行临床实验,其中2个进入三期临床实验阶段。
Kataoka教授的近期部分研究成果具体如下:
1. ACS Nano:双重敏感的纳米胶增强活性抗体系统递送到大脑

阿尔茨海默氏病(AD)抗体疗法在临床上的成功令人失望,主要原因之一是由于存在血脑屏障(BBB),游离抗体进入大脑的能力极为有限。设计能够有效穿越血脑屏障并在生物活性损失最小的情况下将抗体适当释放到脑实质中的纳米载体仍然是一个具有挑战性的问题。在这里介绍了一种聚合纳米胶束(PM)系统,该系统能够以治疗有效水平将抗Aβ的生物活性抗原结合片段抗体(Fabs)特异性地递送到大脑中以抑制Aβ聚集,而周围组织的抗体吸收却最少。
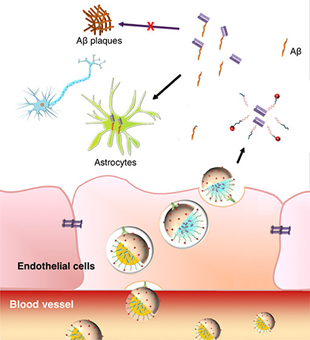
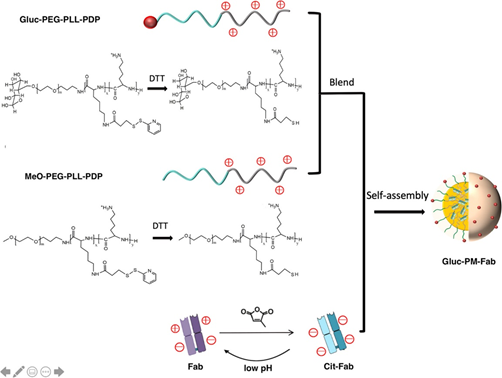
本文要点:
(1)该系统由双pH /氧化还原响应聚合物纳米胶束(PM)组成,该胶束由阳离子二硫键交联的聚(乙二醇)(PEG)-聚(l-赖氨酸)嵌段共聚物与能够在酸性条件下恢复其电荷(和生物活性)的电荷转换阴离子Fab复合。因此,PM在血液循环中具有增强的稳定性,但会在内体和脑实质的酸性和还原性环境中逐步分解,分别由于离子相互作用的丧失和二硫键的断裂,导致释放大量生物活性抗体。
(2)通过用葡萄糖分子对PM表面进行功能化来实现大脑靶向,从而使其与回收的葡萄糖转运蛋白(Glut)-1蛋白相互作用。因此,与游离的3D6-Fab相比,PM体系将大脑中3D6-Fab的积累增加了41倍。此外,给药后的阿尔茨海默氏病小鼠中,有效抑制了Aβ1–42的聚集。因此,该纳米载体系统代表了一种有前途的方法,可以有效地将功能性抗体试剂递送至大脑并治疗神经系统疾病。
JinbingXie, et al. Dual-Sensitive Nanomicelles Enhancing Systemic Delivery ofTherapeutically Active Antibodies Specifically Into the Brain. ACS Nano. 2020May 20.
Doi:10.1021/acsnano.9b09991.
https://doi.org/10.1021/acsnano.9b09991
2. Angew Chem Int Ed:自增强催化纳米反应器与可触发的交联膜网络相集成,用于焦亡引发免疫原性细胞死亡

合成聚合物囊泡刺激了生产具有精确和特定功能的生物智能纳米装置(例如纳米反应器)的新策略。通过通用平台在不影响结构完整性,灵活性和功能性之间进行权衡的情况下,对具有可调节渗透性的囊泡纳米器件进行工程设计仍然具有挑战性。在这里提出了一种通过将刺激响应性接头整合到交联膜网络中来构建基于聚离子复合物囊泡的响应性纳米反应器的通用策略。
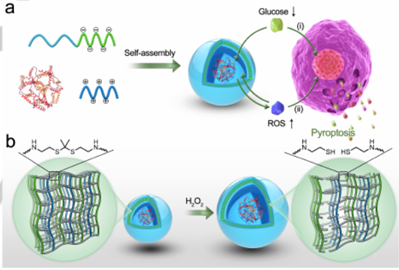
本文要点:
(1)构建了葡萄糖氧化酶(GOD)负载的活性氧(ROS)响应性聚离子复合物囊泡(PICsomes),聚([2-[[1-[(2-氨基乙基)硫代] -1-甲基乙基]硫代]乙基]-α,β-天冬酰胺)(PATK)作为聚阳离子链段和PEG-b-poly(α, β-天冬氨酸)(PEG-b-PAsp)作为聚阴离子链段。暴露于H2O2后,ROS响应性连接键的逐步裂解,膜交联密度降低,膜疏水性至亲水性转变和囊泡肿胀,膜通透性增加,催化葡萄糖氧化的效率提高。
(2)囊泡结构可以在转化过程中保持完整性而不会破裂,这可以保护GOD免受恶劣环境影响,维持长期活性以达到杀细胞功能。此外,通过细胞焦亡作用诱导了细胞死亡的免疫刺激形式,引发强大的抗肿瘤免疫反应。
Junjie Li,et al. Self-Boosting Catalytic Nanoreactor Integrated With TriggerableCrosslinking Membrane Networks for Initiation of Immunogenic Cell Death byPyroptosis. Angew Chem Int Ed Engl. 2020 May 7.
Doi:10.1002/anie.202004180.
https://doi.org/10.1002/anie.202004180
3. Angew Chem Int Ed Engl:葡萄糖包被的聚合物纳米载体跨血脑屏障用于反义寡核苷酸的系统脑递送

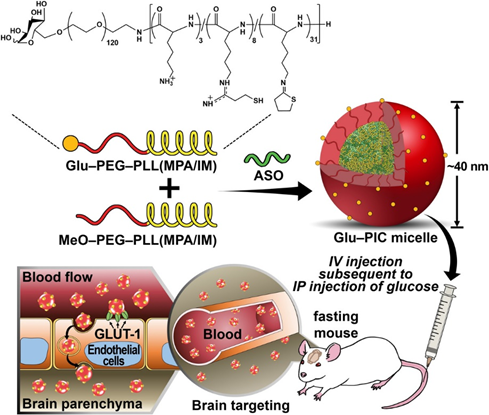
当前的用于治疗中枢神经系统(CNS)疾病的反义寡核苷酸(ASO)疗法是通过侵入性给药进行的,从而给患者带来了沉重负担。为了减轻这种负担,在此报告了通过使用血糖控制作为外部触发因素系统性将ASO递送至大脑,穿越血脑屏障。葡萄糖包被的聚合物纳米载体可以与脑毛细血管内皮细胞上表达的葡萄糖转运蛋白-1((GLUT1))结合,被设计用于稳定包封ASO,其粒径约为45 nm,具有足够的葡萄糖配体密度。
本文要点:
(1)由3-巯基丙基脒和2-硫代丙二胺修饰的聚(乙二醇)-b-聚(l-赖氨酸)嵌段共聚物(PEG-PLL(MPA / IM)自组装的聚离子复合胶束(PIC / M)通过静电结合作用将ASO捕获在核心中,并被紧密相关的PEG链的外壳包围,以确保血液循环的寿命。此外,通过将具有巯基的PEG-PLL中聚(l-赖氨酸)链段的侧链部分衍生化,将二硫键交联引入PIC / M核中。这样, PIC / M由于在核心中形成二硫键交联而在非还原性血液室中变得更加坚固,但它在大脑的还原性条件下会通过二硫键的裂解,释放出货物ASO。2-硫代丙二胺基团也被引入聚(1-赖氨酸)链段,以通过疏水/偶极相互作用进一步稳定胶束结构。值得一提的是,通过更改PEG段远端有和没有葡萄糖部分的嵌段共聚物的混合比例,可以轻松实现PIC / M表面上葡萄糖配体的密度调节。
(2)将葡萄糖溶液腹膜内注入禁食过夜的小鼠中,以触发GLUT1移位和循环回收。然后,将Glu-PIC / Ms静脉内注射到小鼠体内,以从血流到脑实质进行GLUT1介导的胞吞作用。经过优化的纳米载体在静脉内给药后1小时有效地积聚在脑组织中,并且在各个脑区中均显示出对目标非编码RNA的显著抑制作用,包括大脑皮层和海马。这些结果表明,葡萄糖修饰的聚合物纳米载体能够对脑进行无创ASO给药,以治疗CNS疾病。
HyunSu Min, et al. Systemic Brain Delivery of Antisense Oligonucleotides Across theBlood-Brain Barrier With a Glucose-Coated Polymeric Nanocarrier. Angew Chem IntEd Engl. 2020 Jan 29.
DOI:10.1002/anie.201914751.
https://doi.org/10.1002/anie.201914751
4. JACS:囊泡性聚离子复合物(siRNAsomes)用于RNAi和生物大分子的共递送

聚合物囊泡由于其具有可调节膜的独特中空结构而最近引起了相当大的关注。然而,将生物活性大分子(BMs)特别是强亲水性或带电荷的有效且稳定地包埋在囊泡膜中仍然是主要的挑战。解决上述问题的一种先进方法是利用BM作为自组装成分而不是简单包含物来制造聚合物囊泡。
本文要点:
(1)本研究首次使用带电且刚性的BM(即siRNA)作为自组装组件来制造囊泡结构,合成了聚(乙二醇)-嵌段-聚[N-(5-氨基戊基]-α,β-天冬酰胺](PEG-b-P(Asp-AP)),选择P(Asp-AP)作为阳离子片段,先前的研究表明聚天冬酰胺中相对较长的烷基侧链可用于 PICsome的形成。通过结构分析,从大小,表面电荷,形态和离聚物组成等方面验证了基于siRNA的PICsome(siRNAsome)的形成,最终证明了siRNAsomes可能将siRNA递送至细胞。
(2)siRNAsome通过简单的涡旋混合将葡聚糖稳定地封装在模腔中,作为模型生物大分子。共聚焦激光扫描显微镜观察显示,两种药物都被内化到细胞中。结果证明了siRNAsomes作为与其他生物大分子一起共递送的通用平台的潜力。
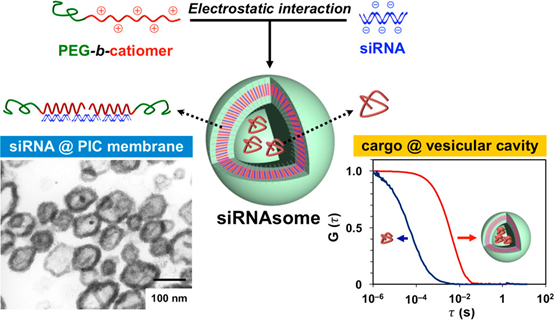
BeobSoo Kim, et al. Self-Assembly of siRNA/PEG- b-Catiomer at Integer Molar RatioInto 100 nm-Sized Vesicular Polyion Complexes (siRNAsomes) for RNAi andCodelivery of Cargo Macromolecules. J Am Chem Soc. 2019 Feb27;141(8):3699-3709.
Doi:10.1021/jacs.8b13641.
https://doi.org/10.1021/jacs.8b13641
5. ACS Nano:具有肿瘤特异性可激活级联反应的治疗性聚合物纳米反应器

在精确的癌症治疗中,治疗性纳米反应器可从惰性前药或内在分子在目标部位就地产生治疗性化合物。然而,设计具有肿瘤可激活级联反应的纳米反应器以进行有效的协同癌症治疗仍然是一个巨大的挑战。在本文中证明了具有肿瘤酸性响应的膜通透性的多聚体纳米反应器可以激活级联反应,以进行有组织的联合癌症治疗。
本文要点:
(1)基于•OH和肿瘤pH敏感的嵌段共聚物前药,合理地设计了超小型氧化铁纳米颗粒(USIONs)和葡萄糖氧化酶(GOD)负载的治疗性聚合物纳米反应器(Fe / G @ R-NRs )。肿瘤酸性微环境可通过超敏感的pH响应膜通透性和小分子转运特异性地引发级联反应,包括(i)在GOD催化下葡萄糖氧化并伴随产生H 2 O 2和葡萄糖酸,(ii)加速铁离子在酸性条件下释放,(iii)H 2 O 2和铁离子之间的Fenton反应导致•OH的生成,以及(iv)通过硫代缩酮连接键的裂解而•OH触发的喜树碱(CPT)释放。
(2)在此过程中,通过原位消耗和产生的化合物实现了包括饥饿疗法,化学动力学疗法和化学疗法在内的精心设计的协同癌症疗法,实现高效肿瘤抑制。抗肿瘤评估表明,在小鼠肿瘤模型中,静脉内施用的纳米反应器可以有效抑制A549人肺肿瘤和侵袭性H22小鼠肝癌。
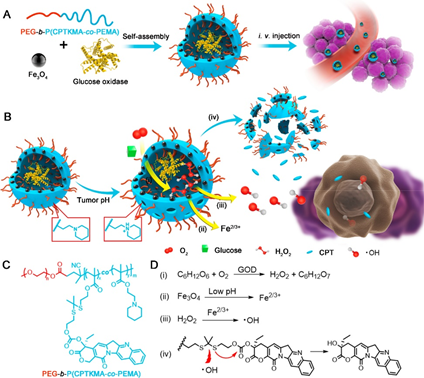
WendongKe, et al. Therapeutic Polymersome Nanoreactors With Tumor-Specific ActivableCascade Reactions for Cooperative Cancer Therapy. ACS Nano. 2019 Feb26;13(2):2357-2369.
Doi:10.1021/acsnano.8b09082.
https://doi.org/10.1021/acsnano.8b09082
6. ACS Nano:地塞米松通过使肿瘤微环境正常化,提高了包载顺铂的纳米载体在转移性乳腺癌中的递送和功效

地塞米松是一种具有抗炎特性的糖皮质激素,可用于治疗包括癌症在内的多种疾病。在这里考察了地塞米松在转移性乳腺癌(BC)中的肿瘤微环境(TME)正常化作用。
本文要点:
(1)地塞米松可正常化血管和细胞外基质,从而降低组织间液压力,组织刚度和固体压力。反过来,代表纳米载体(NCs)的13和32 nm葡聚糖的渗透性也增加了。肿瘤中流体和大分子转运的力学模型预测,地塞米松可通过增加组织间水力传导率而不会显著减小血管壁的有效孔径来增加NC渗透。
(2)此外,地塞米松还可以增加约30 nm含顺铂(CDDP / m)的聚合物胶束对原发性BC小鼠模型和自发性BC肺转移的肿瘤蓄积和功效,而这些模型也具有具有异常机械特性的TME。这些结果表明,在NC给药之前用地塞米松进行预处理可以提高针对原发性肿瘤和转移的疗效。
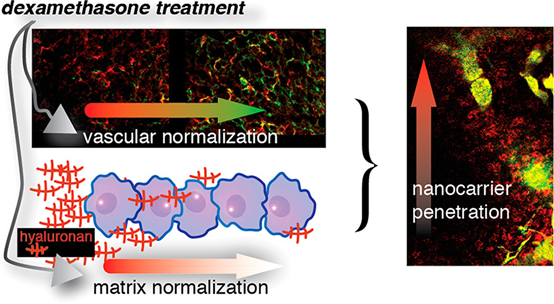
John DMartin, et al. Dexamethasone Increases Cisplatin-Loaded Nanocarrier Deliveryand Efficacy in Metastatic Breast Cancer by Normalizing the TumorMicroenvironment. ACS Nano. 2019 Jun 25;13(6):6396-6408.
Doi:10.1021/acsnano.8b07865.
https://doi.org/10.1021/acsnano.8b07865











