
第一作者:何伟、邢续扬、王晓玲
通讯作者:郭俊凌、Samir Mitragotri
通讯单位:四川大学、哈佛大学
核心内容:
1.汇总了已上市以及临床研究阶段的生物药纳米制剂,并着重介绍了近些年新型纳米载体在生物药递送中的应用与进展。
2. 系统地阐述了生物药纳米制剂主要的入胞机制,总结纳米制剂通过溶酶体逃逸途径来实现生物药胞内递送的策略,同时重点介绍纳米制剂通过非溶酶体途径直接将生物药递送入胞的途径。
生物药物面临的挑战
在人类对抗各种重大疾病或罕见疾病的过程中,生物药物从未缺席过,从1981年开始的乙肝疫苗上市,1982年胰岛素的临床应用,到1996年基因治疗致死事件引发的各种质疑,2011-2015年GLP-1、CTLA-4、PD-1等的成功开发,2018年siRNA的上市,再到目前全人类在孜孜以求的COVID-19疫苗,生物药物的研究与开发可谓坎坎坷坷。近年来取得了明显的突破,生物药物的研发已势不可挡,呈现快速增长的势头。但由于结构的特殊性与内在特点等,低生物利用度与给药的不便捷性已经成为限制生物药物应用的瓶颈。为了解决此问题,可以利用纳米载体对生物药物进行胞内高效递送,从而更好地发挥生物药的疗效。
综述简介
有鉴于此,四川大学“高层次海外人才计划”郭俊凌教授,哈佛大学工程院及医学院双院院士Samir Mitragotri教授,以及中国药科大学何伟副教授团队系统讨论和总结了近些年新型纳米载体用于大分子药物细胞内递送的最新进展;系统地阐述生物药纳米制剂主要的入胞机制,为新型制剂开发设计以及其在生物药胞内高效递送方面提供新的思路。
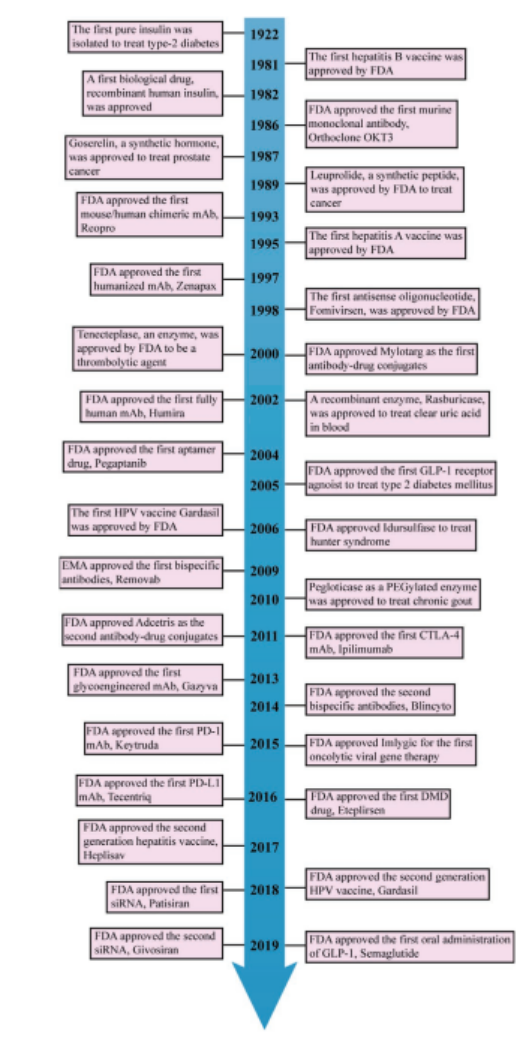
图1. 生物制药的典型临床应用的示意图。
要点1:纳米粒子的细胞摄取机制
纳米粒子(NPs)可以通过内吞作用进入细胞,在这个过程中,细胞膜吞噬NPs并分裂后在细胞内形成一个独立的囊泡。内吞作用机制包括吞噬作用、巨胞饮作用、网格蛋白和小窝蛋白介导的内吞作用,以及网格蛋白和小窝蛋白独立途径。吞噬主要发生在免疫细胞,如树突状细胞、T细胞、B细胞、中性粒细胞和巨噬细胞,作为清除异物的手段。
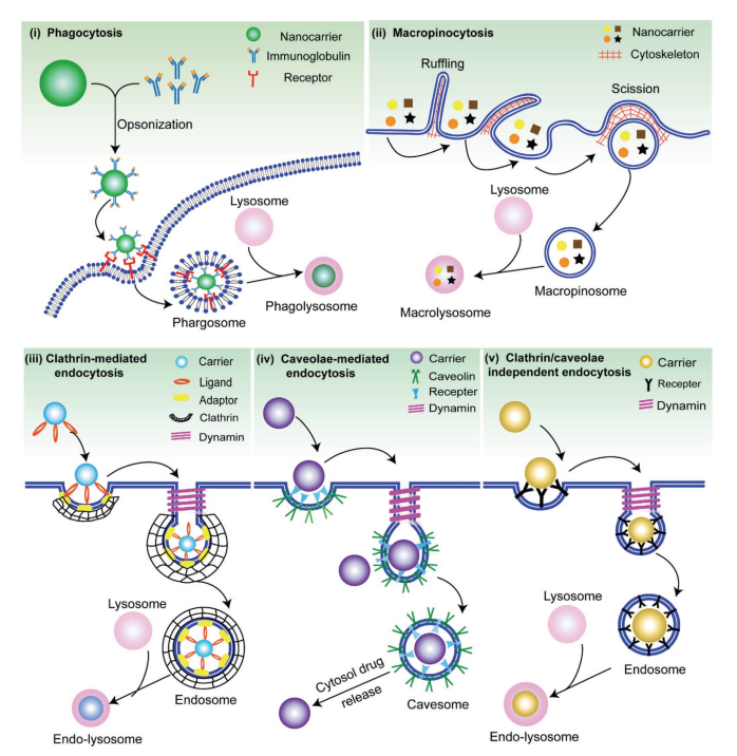
图2. 主要内吞作用示意图。
要点2:通过内涵体逃逸的细胞溶质传递
具有增强内体逃逸能力的纳米颗粒是生物递送的最佳选择。用于生物制剂内吞和递送的常用纳米颗粒包括脂质体和脂基NPs、聚合物胶束和聚合物NPs、脂-聚合物混合NPs、纳米晶体以及无机NPs,如金NPs、磁性NPs、碳纳米管、石墨烯、量子点和硅NPs。核内体逃逸的机制涉及核内体膜的不稳定,通过增加核内体膜和核内溶剂(如pH敏感的溶膜化合物或聚合物)之间的相互作用。目前,核内体逃逸的主要策略包括:(1)核内增强剂使核内体溶解;(2)核内体膜孔形成;(3)高pH缓冲剂介导质子海绵效应;(4)通过融合剂干扰内吞体膜形成膜融合;(5)光敏剂对内体膜进行光化学破坏。
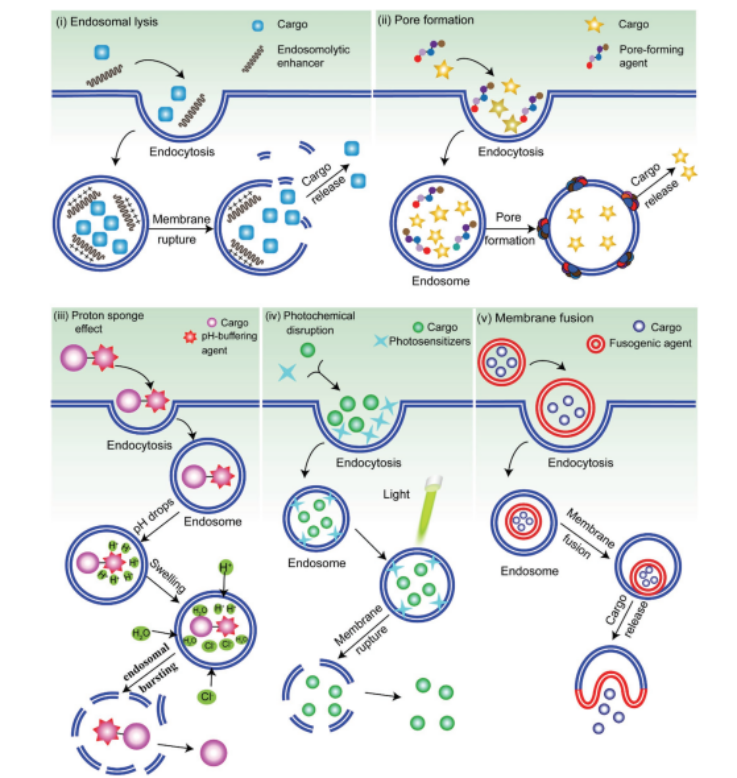
图3. 五种策略的示意图,以实现成功的内体逃逸。
内体孔的形成是由促进孔放大的膜张力和趋向于关闭孔的线张力之间的平衡决定的。缩氨酸等促孔剂通过与孔的边缘结合,降低了线张力,促进了稳定孔的形成。
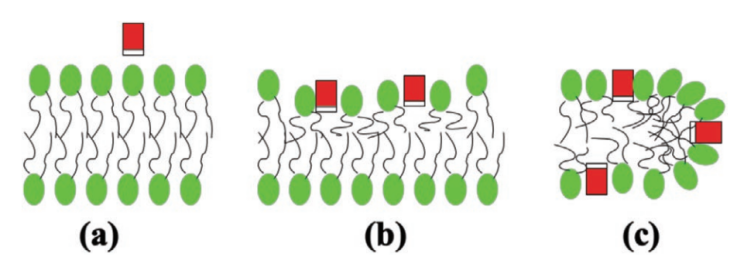
图 4. 肽(矩形)和脂双层之间的相互作用。
孔隙的形成类似于一个相变过程,当阳离子脂质体被包裹在核内体中,通过破坏核内体膜的稳定性,诱导反六边形相变,促进非双层结构和局部孔的形成。
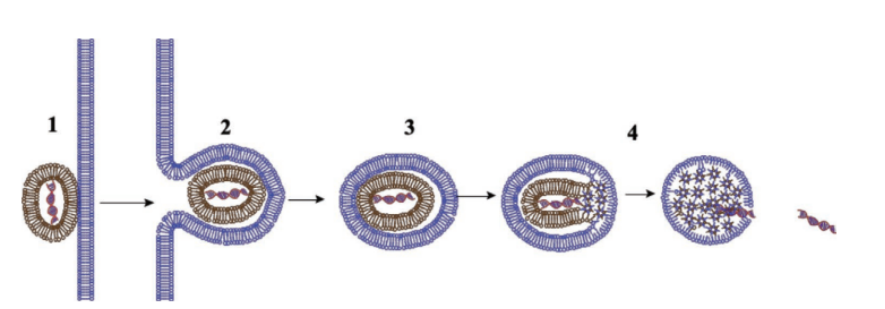
图 5. 质粒DNA -阳离子脂质复合物(脂质体)中阳离子脂质介导的质粒胞内传递模型。
要点3:细胞内直接递送
虽然已经开发了各种方法来加强核内体逃逸,包括直接胞浆递送绕过核内体包裹和完全通过将生物直接递送到细胞浆而逃逸,这些途径包括小窝介导途径、
接触释放和膜间转移、膜融合、胞内直接易位、膜破裂和显微注射。讨论了细胞内直接递送策略以及它们的优缺点,这些策略已经被开发出来以解决胞浆递送的挑战。
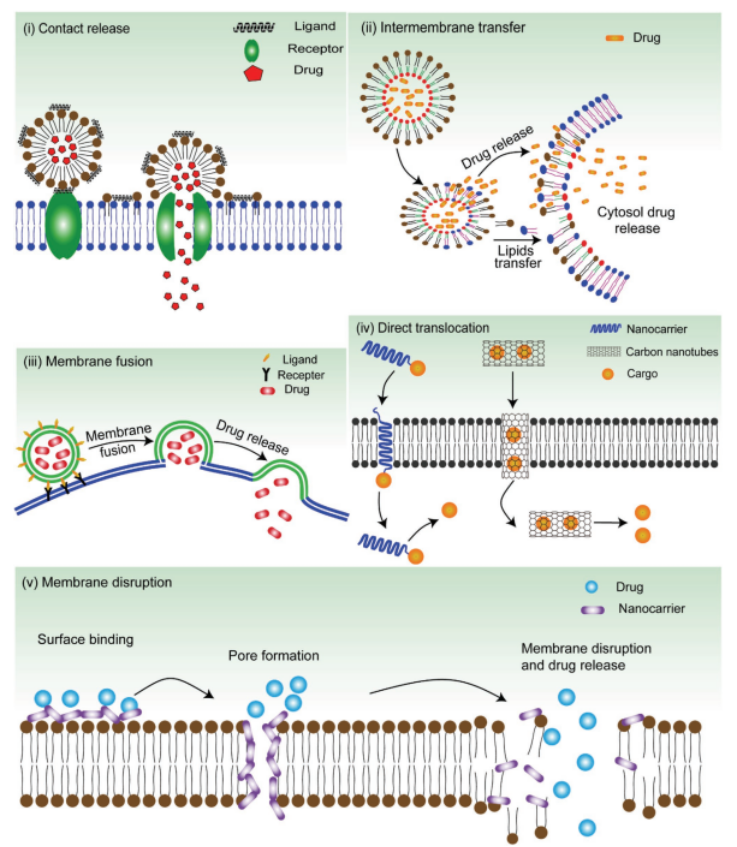
图 6. 通过使用纳米颗粒实现货物直接胞浆传递的五种方法的示意图。
总结与展望
1. 纳米载体的药物递送技术的挑战
(1)纳米载体进行细胞内药物递送并发挥功效主要受内在化方式和细胞内运输的控制。NPs的内吞作用是一种主要途径,但核内体包裹导致了胞浆递送的可能性降低。
(2)用于诱导核内体逃逸的材料可能受到毒性的限制。
(3)直接胞浆内给药是一种有前景的生物制剂胞内给药策略,因为它能将几乎100%的包裹物送到细胞质中,但存在安全问题需要解决。
(4)在膜破裂的情况下,复杂的设计和缺乏生物相容性严重阻碍了许多纳米载体的应用。
(5)传统的探针通常用于跟踪NPs在细胞中的传输,但它们无法区分纳米粒子封装的探针信号和释放探针产生的信号。不明确的信号导致NPs的胞内释放难以定量,影响了NPs的合理设计。
2. 纳米载体的药物递送技术的研究方向
(1)采用其他的药物递送方法或者降低纳米粒子潜在毒性,同时改善胞浆内给药差的问题。
(2)安全性高又具有可伸缩性的NPs将继续成为转化生物学的重点。
(3)使用非天然碳水化合物的代谢性低聚糖代谢细胞标记和成像技术可能具有较高的生物相容性和特异性,可有效评估纳米载体的细胞药代动力学。
(4)采用基于聚集引起的猝灭、聚集诱导的发射、förster共振能量转移的环境响应荧光探针等技术量化纳米载体并准确监测的潜在工具。
纳米载体研究用于大分子药物细胞内递送,蕴藏着巨大的机遇和挑战!
参考文献
He, Wei, Xuyang Xing, Xiaoling Wang, Debra Wu, Wei Wu, Junling Guo*, and Samir Mitragotri*. "Nanocarrier-Mediated Cytosolic Delivery of Biopharmaceuticals." Advanced Functional Materials (2020): 1910566.
DOI: 10.1002/adfm.201910566
https://doi.org/10.1002/adfm.201910566
作者简介

郭俊凌教授简介:“国家高层次海外人才计划”,四川大学“双百人才”工程项目获得者郭俊凌教授,博士生导师,墨尔本大学化学与分子生物学博士,美国哈佛大学Wyss仿生工程研究中心Wyss Fellow,依托四川大学国家“双一流”重点建设学科,课题组构建了生物质先进材料与纳米界面研究中心(bmicenter.org)。近年来,团队相关研究以在Science《科学》、Nature Nanotechnology《自然-纳米技术》、Energy & Environmental Science《能源与环境科学》、Angewandte Chemie《德国应用化学》等国际顶级期刊上发表,多项突破性研究也被国际著名的“F1000创新型学术评价系统”评为领域重大研究,被Nature Nanotechnology《自然-生物技术》等学科顶级杂志选为特别专题与研究热点。

生物质先进材料与纳米界面研究中心(bmicenter.org)是一个高度跨学科的研究团队。团队旨在对生物质资源的高值转化利用,构建全生物基的新型功能材料,并探索材料微观结构、界面行为、生物纳米相互作用等基础科学问题。研究方向主要涉及“金属-多酚网络MPNs”先进材料的研究与工程应用、生物质界面前沿科学的研究和应用开发,致力于环境科学与工程、先进生物医学工程等前沿领域的基础及工程研究。团队依托四川大学国家“双一流”重点建设学科,搭建了国内顶尖的科研平台,拥有丰富的科研资源和顶尖的科研设施。本团队鼓励国际合作、多学科交叉、跨领域交流、以及先进技术转化。研究中心与美国,澳大利亚,芬兰等多国著名研究机构和大学建立了稳定而深入的合作关系,每年推荐优秀成员到哈佛大学,MIT,墨尔本大学,东京大学等世界一流大学学习交流。BMI研究中心欢迎优秀博士、硕士研究生申报,并招收博士后、研究助理2名(硕士及以上学历)。
联系方式
郭俊凌教授,邮件标题注明:博士生/研究生申请+姓名+毕业学校。
邮箱:junling.guo@scu.edu.cn或中心网站https://www.bmicenter.org/











