尽管NIR-I成像比可见光波长下的成像性能要好,但是光学成像研究的最新进展表明,通过在第二个NIR窗口(NIR-II,1,000-1,700nm)中进行检测,可以更好地提高活体的成像质量。这主要归因于组织自体荧光减弱、光子散射减弱以及较长波长的光子吸收水平较低。在使用NIR-II窗口时,包括对厘米组织的光探测、毫米深度的微米分辨率和高对比度,这些性能得到显著提高且可以实时实现。如,奇物论先前报道的中科院自动化研究所田捷研究员发表在Nature Biomedical Engineering上的用于临床手术。怒赞!近红外II区荧光探针引导首次临床手术!
本期顶刊趋势,奇物论编辑部针对近期关于NIR-II相关的研究进行总结,供大家学习和交流!(注:前两篇奇物论近日尚未进行报道)
1. Nano. Today:稳定明亮的AIE点用于对大鼠进行NIR-II成像

新兴的近红外II区(NIR-II)荧光成像具有非常广阔的应用前景,其在小动物的体内成像领域已被广泛研究,但其在大动物模型上的拓展还未开始。香港科技大学唐本忠院士和浙江大学钱骏教授首次利用聚集诱导发光(AIE)点对活鼠脑血管和主要器官进行NIR-II成像。
本文要点:
(1)所实验制备的AIE点具有较高的光亮度和良好的稳定性及生物相容性。由于其有着长的发射范围和高发光亮度,因此该AIE点可以对大鼠的大脑血管进行体内NIR-II荧光显微成像,并具有高的空间分辨率(~4 μm)和深部穿透 (700 μm)等优点,这也是目前大鼠大脑成像领域可实现的最高穿透深度和最佳分辨率。
(2)与此同时,该NIR II AIE点可用于对脑血栓早期的微小血管堵塞进行实时检测,并能够对大鼠的胃肠道和膀胱进行无创监测,进而有助于更好地了解大鼠的消化系统和排泄过程。综上所述,这一研究工作也为发展先进的NIR-II大动物成像提供了重要的参考。
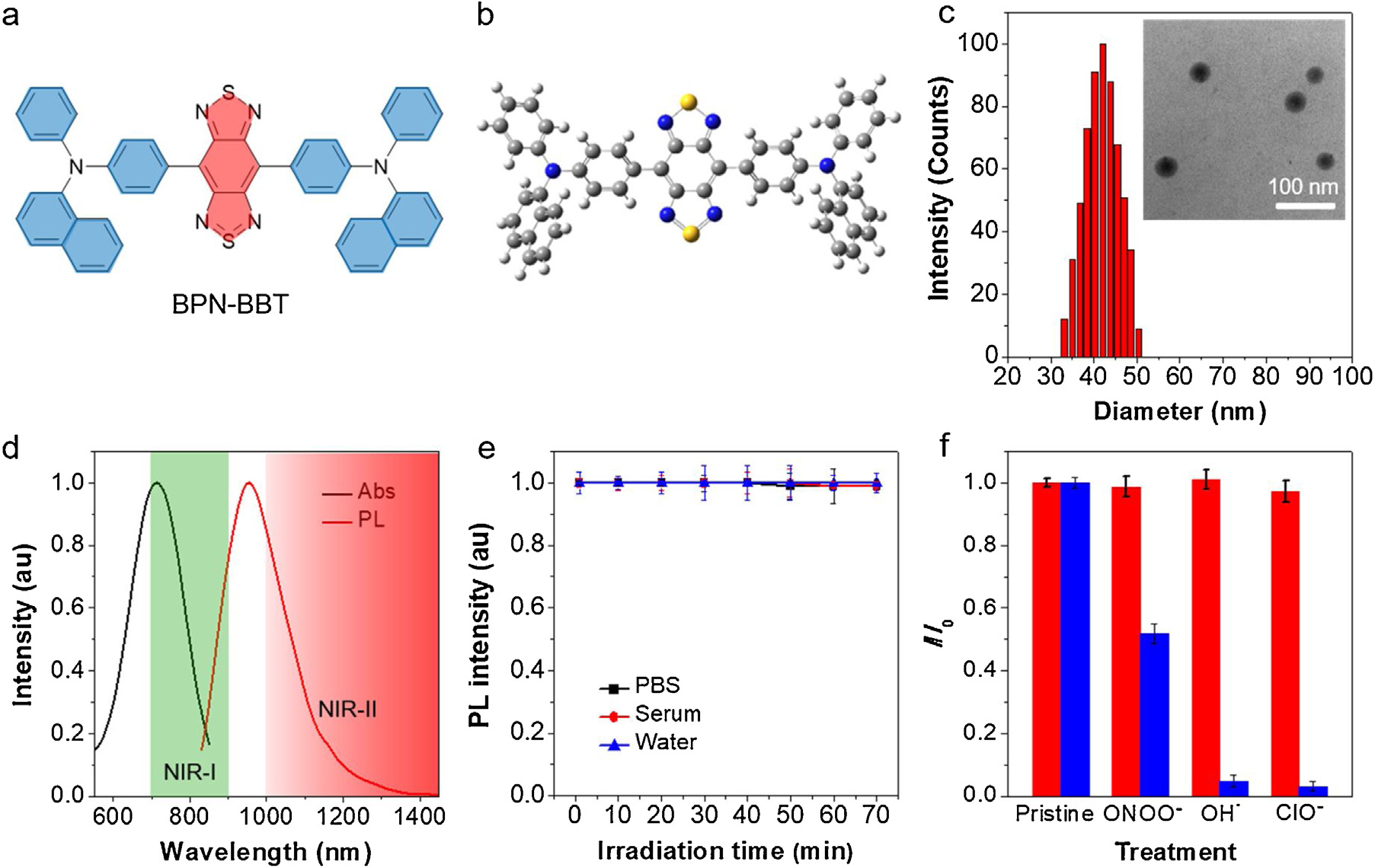
Ji Qi. et al. Highly stable and bright AIE dots for NIR-II deciphering of living rats. Nano Today. 2020
https://www.sciencedirect.com/science/article/pii/S1748013220300621
2. Nature Commun.:具有长血液半衰期的有机NIR-II分子,用于体内动态血管成像

实时监测血管功能障碍在临床前期研究中具有重要意义。第二个近红外(NIR-II)窗口中的光学生物成像具有许多优点,包括高分辨率和快速反馈。然而,已报道的分子染料由于血液循环时间有限(~5~60 min),吸收和发射波长较短,影响了准确的长期监测。有鉴于此,复旦大学的张凡等研究人员,报道了一个吸收和发射超过1000nm的NIR-II分子(LZ-1105)。
本文要点
1)由于较长的血液循环时间(半衰期为3.2 h),该荧光团可用于实时实时监测动态血管过程,包括后肢的缺血性再灌注,颈动脉的溶栓以及血脑屏障的开放和恢复(BBB)。
LZ-1105为研究人员提供了一种评估由于长激发和发射波长以及长期血液循环特性而导致的血管功能障碍的方法。
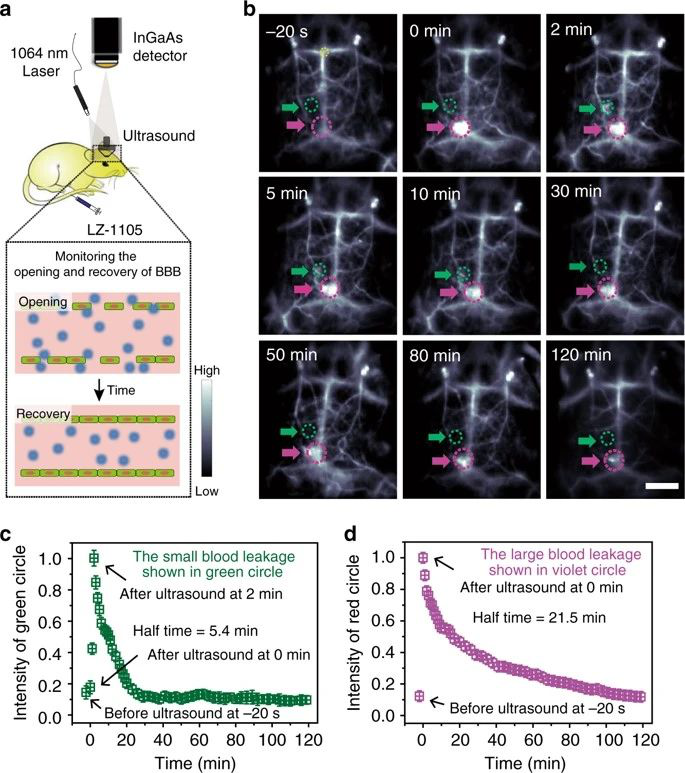
Benhao Li, et al. Organic NIR-II molecule with long blood half-life for in vivo dynamic vascular imaging. Nature Communications, 2020.
DOI:10.1038/s41467-020-16924-z
https://www.nature.com/articles/s41467-020-16924-z
3. AM:一种肿瘤微环境响应型FRET传感器用于肝癌原位成像
第二近红外(NIR-II)窗口的深层组织成像为广泛的基础研究提供了广阔的前景。然而,由于组织吸收和散射导致的不均匀信号衰减,阻碍了其在体内精确生物传感中的应用。在此,复旦大学Fan Zhang等人提出了一种利用肿瘤微环境(过氧亚硝酸盐,ONOO−)响应型镧系-花菁Förster共振能量转移(FRET)纳米传感器在近红外区域进行基于寿命的原位肝细胞癌(HCC)检测方法。
本文要点:
1)合成了一种特殊设计的响应型NIR-II染料MY-1057作为FRET受体。
2)研究表明,鲁棒寿命传感与组织穿透深度无关。由于恢复寿命,肿瘤病变与正常组织可以准确地区分开来。
3)磁共振成像和肝脏解剖结果表明,在单个和多个HCC模型中,基于寿命的检测是可靠的。此外,还可以根据肺癌的标准曲线计算ONOO−的量。
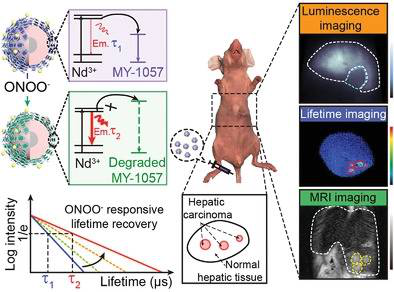
Mengyao Zhao, et al. A Tumor‐Microenvironment‐Responsive Lanthanide–Cyanine FRET Sensor for NIR‐II Luminescence‐Lifetime In Situ Imaging of Hepatocellular Carcinoma, Adv. Mater., 2020.
DOI: 10.1002/adma.202001172
https://doi.org/10.1002/adma.202001172
4. Chem. Sci综述:控制AIE分子的结构和发光过程以用于近红外II区诊疗
香港科技大学唐本忠院士对如何控制AIE分子的结构和发光过程以实现近红外II区诊疗应用的研究进行了综述总结。
本文要点:
(1)聚集诱导发光(AIE)是一种前沿的荧光技术,可以产生高效率的光致发光。在近红外II区 (NIR-II, 1000-1700 nm)范围内发光的AIE发光分子则在生物医学成像和治疗方面表现出了显著的优势。然而在这些窄带隙的材料中,如何通过分子设计以调节其荧光(辐射途径)和光热 (非辐射途径)的平衡以及其中潜在的机制目前仍不清楚。
(2)作者在文中综述了近年来开发具有 AIE特性的高效NIR-II发光体和光热试剂方面所取得的最新进展,并对从单分子到分子聚集体的多级结构进行调节来优化荧光效率的研究做了重点介绍;随后作者讨论了分子聚集体中的分子内运动对于平衡荧光成像和光热治疗功能的关键作用,展示了NIR-II区AIE分子在对血管和大脑进行荧光/光声成像以及肿瘤的光热治疗方面的优势;最后作者也对NIR-II区AIE分子在体内应用所面临的挑战和发展前景进行了展望。
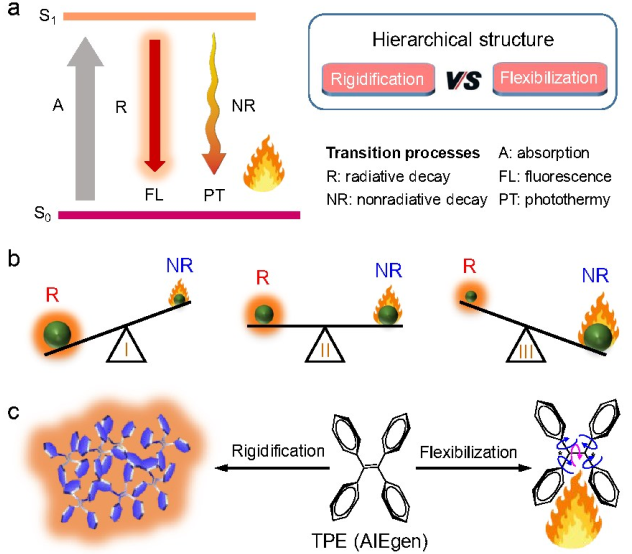
Shunjie Liu. et al. Structural and process controls of AIEgens for NIR-II theranostics. Chemical Science. 2020
https://pubs.rsc.org/en/content/articlelanding/2020/sc/d0sc02911d#!divAbstract
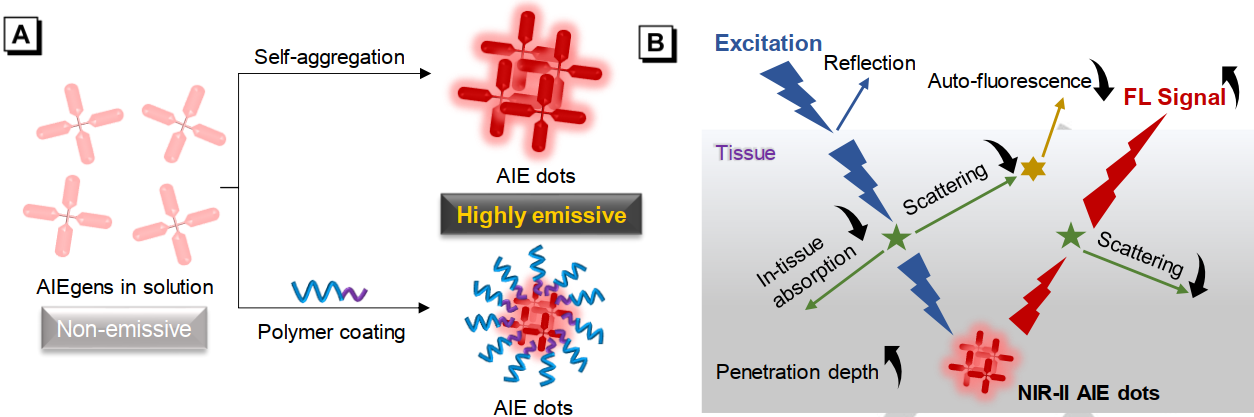
5. Angew综述:近红外II区 AIE分子及其生物医学应用
香港科技大学唐本忠院士和深圳大学王东副教授对开发近红外II区 AIE分子及其在生物医学领域的应用研究进行了综述展望。
本文要点:
(1)聚集诱导发光分子 (AIEgens)及其在近红外二区(NIR-II)的荧光成像应用是一个新兴的研究领域。NIR-II AIEgens可以有效克服光穿透深度不足和荧光效率低等瓶颈,因此可以提供更高精度的高性能成像结果。目前已有的一些NIR-II AIEgens可以实现荧光-光声双模态成像以及荧光成像指导的光热治疗,不仅可以提高诊断的准确性,而且也有望实现临床转化。
(2)作者在文章中从分子设计策略和生物应用等方面综述了近年来国内外开发NIR-II AIEgens的研究进展,并对这一领域目前面临的挑战和发展前景进行了讨论和展望。
Wenhan Xu. et al. NIR-II AIEgens: A Win-Win Integration towards Bioapplications. Angewandte Chemie International Edition. 2020
DOI: 10.1002/anie.202005899
https://onlinelibrary.wiley.com/doi/10.1002/anie.202005899
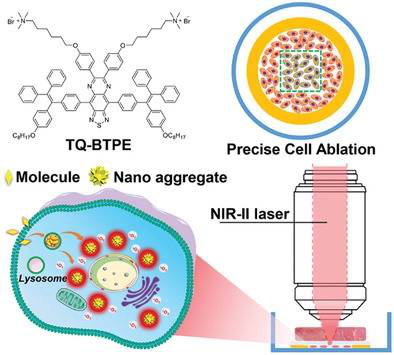
6. AFM:NIR-II激活具有聚集诱导发射的光敏剂用于精确高效的双光子光动力肿瘤细胞消融
近红外(NIR)光激发光敏剂对于深度穿透的光动力疗法是非常理想的。在此,新加坡国立大学刘斌等人设计了一种NIR-II光(1200 nm)激活光敏剂TQ-BTPE,利用聚集诱导的单重态氧(1O2)产生进行双光子光动力肿瘤细胞消融。
本文要点:
1)TQ-BTPE在NIR-II激光激发下表现出良好的双光子吸收和明亮的聚集诱导的NIR-I发射。在白光照射下,TQ-BTPE在水介质中产生的1O2比商品化光敏剂Ce6高得多。在NIR-II激发下,TQ-BTPE的双光子光敏性比Ce6高7倍。
2)HeLa细胞内化的TQ-BTPE分子大多以小聚集点的形式存在于溶酶体中,在细胞内分布均匀,有利于高效的光动力细胞消融。
3)由于TQ-BTPE在920 nm处有更大的双光子吸收截面,TQ-BTPE在NIR-I和NIR-II激发下的双光子光敏效应表现出比在NIR-I激发下更高的1O2产生效率, NIR-II光在穿过新鲜猪肉组织后表现出更好的生物组织穿透能力,这有利于更强的双光子光敏作用和更好的癌细胞消融性能。这项工作突出了NIR-II光激发光敏剂用于深层组织光动力治疗的前景。
Shaowei Wang, et al. NIR‐II Light Activated Photosensitizer with Aggregation‐Induced Emission for Precise and Efficient Two‐Photon Photodynamic Cancer Cell Ablation, Adv. Funct. Mater., 2020.
DOI: 10.1002/adfm.202002546
https://doi.org/10.1002/adfm.202002546
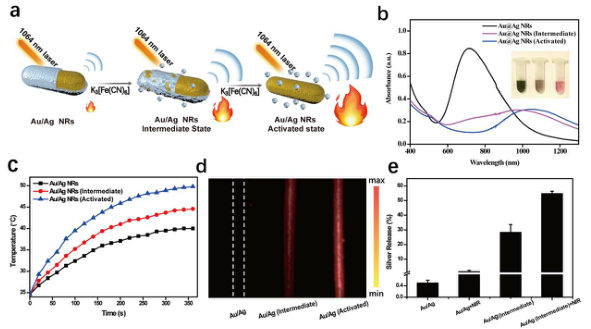
7. Biomaterials:微型Au/Ag纳米棒实现NIR-II光声成像及光化学协同治疗多药耐药金黄色葡萄球菌感染
多药耐药金黄色葡萄球菌(MRSA)严重危害人类健康。开发有效的方法来消除感染和监测治疗过程具有重要意义。近红外-II (NIR-II)光声(PA)成像和光热治疗(PTT)是高度集成的治疗平台,具有成像背景低、组织穿透深度大、光热阈值高等优点。在此,上海交通大学周建桥、中国科学院深圳先进技术研究院盛宗海、广州中医药大学第一附属医院赵萍等人报告了一种利用微型Au/Ag纳米棒(NRs)的可激活NIR-II光疗策略,用于MRSA感染的光化学协同治疗和原位监测治疗过程。
本文要点:
1)铁氰化物溶液能有效地活化Au/Ag NRs,并允许其持续释放游离Ag+以消除MRSA,触发NIR-II光热和PA性能的增强。
2)激活的NIR-II光热效应反过来加速了Au/Ag NRs中游离Ag+的释放,从而协同清除革兰氏阳性金黄色葡萄球菌,促进创面愈合。
3)治疗小鼠未观察到光热损伤或游离Ag+引起的副作用。
4)协同处理后,植入部位和正常组织之间的NIR-II PA信号增加了20倍,最大信噪比为9.5,从而能够灵敏地监测Ag+的释放过程。
5)所制备的Au/Ag NRs具有良好的稳定性和生物相容性,在NIR-II光疗中显示出巨大的应用潜力。
Zihan Mei, et al. Activatable NIR-II photoacoustic imaging and photochemical synergistic therapy of MRSA infections using miniature Au/Ag nanorods, Biomaterials, 2020.
https://doi.org/10.1016/j.biomaterials.2020.120092
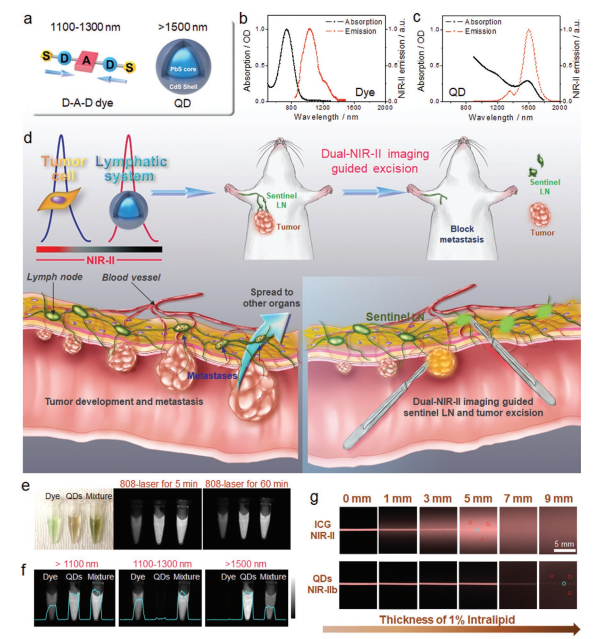
8. AM: 多重NIR-II探针用于淋巴结侵入的癌症检测和成像引导手术
肿瘤淋巴结(LN)转移是肿瘤分期和治疗决策的主要预后因素。然而,同时可视化转移和进行成像引导的淋巴结手术是具有挑战性的。于此,美国国立卫生研究院陈小元、南方科技大学梁永晔、武汉理工大学张明曦和吉林大学朱守俊等人报道了使用非重叠NIR-II探针的多重近红外-II(NIR-II)体内成像系统,其具有显着抑制的光子散射和零自发荧光,从而可以可视化转移性肿瘤和肿瘤转移性近端LNs切除。
本文要点:
1)在NIR-IIa(1100-1300 nm)窗口中,筛选了一种明亮且寻求肿瘤的供体-受体-供体(D-A-D)染料IR-FD,以进行原发/转移性肿瘤成像。这种优化的D-A-D染料在水溶液(≈6.0%)中表现出大大提高的有机D-A-D荧光团的量子产率和良好的体内性能。
2)具有致密聚合物涂层的超亮PbS/CdS核/壳量子点(QD)用于在NIR-IIb(>1500nm)窗口中可视化癌症侵入的前哨LN。与临床使用的吲哚菁绿相比,QD显示出优异的亮度和光稳定性(即使在连续激光照射5小时后也没有明显的漂白);因此,前哨LN检测仅需要皮摩尔剂量。这种双NIR-II图像引导手术的组合可以在明亮的光线下进行,增加了其在临床使用中的便利性和吸引力。
Tian, R., et al. Multiplexed NIR‐II Probes for Lymph Node‐Invaded Cancer Detection and Imaging‐Guided Surgery. Adv. Mater. 2020, 32, 1907365.
https://doi.org/10.1002/adma.201907365
9. AFM:快速清除的超小半导体聚合物点用于NIR-II光声成像和光热肿瘤治疗
第二近红外(NIR-II)窗口(1000-1700 nm)的光疗剂因其增强的穿透深度和最小化的组织暴露,正成为一种很有前景的精密医学治疗平台。用于影像引导治疗的可代谢的NIR-II纳米药物的开发对于非侵入性疾病诊断和肿瘤的精确消融至关重要。在此,澳门大学袁振等人首次报道了用于光声成像引导光热治疗(PTT)的可代谢高吸收NIR-II共轭聚合物点(Pdots)。
本文要点:
1)低带隙D-A π共轭聚合物(DPP-BTzTD)的独特设计与改进的纳米再沉淀条件相结合,使得制备出具有超小粒径(4 nm)的NIR-II吸收的Pdots成为可能。
2)大量的实验测试表明,所构建的Pdots具有良好的生物相容性、优异的光稳定性、明亮的光声信号和较高的光热转换效率(53%)。
3)此外,通过尾静脉注射荷瘤小鼠,Pdots还显示出高效的肿瘤消融能力,并能迅速从体内排泄。
4)体外和体内实验结果均表明,在0.5 W cm−2的1064 nm激光照射下,Pdots具有优异的PTT性能,远低于其最大允许曝光限值1 W cm−2。
综上所述,此初步研究为开发用于临床转化的有机半导体纳米制剂开辟了新的途径。
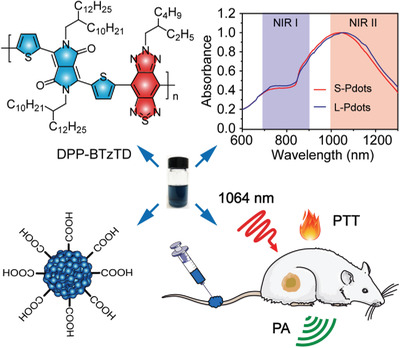
Xiaoju Men, et al. Ultrasmall Semiconducting Polymer Dots with Rapid Clearance for Second Near‐Infrared Photoacoustic Imaging and Photothermal Cancer Therapy. Adv. Func. Mater., 2020.
DOI: 10.1002/adfm.201909673
https://doi.org/10.1002/adfm.201909673
10. ACS Nano:生物响应性等离子体组件—用于NIR-II窗口光声成像引导的同步化疗免疫治疗
常规抗癌疗法,如化疗和放疗的临床疗效受耐药性、全身毒性和实体肿瘤缺氧性质的限制,对远处肿瘤的生长和转移无效。基于此,福州大学杨黄浩、宋继彬,中科院长春应化研究所李占伟等人开发了双生物响应性纳米间隙金纳米粒子囊泡,负载免疫抑制剂并携带抗癌聚合物前药,用于协同抗原发性和转移性肿瘤的同步化疗免疫治疗,同时在第二近红外(NIR-II)窗口通过光声(PA)成像引导载物释放。
本文要点:
1)通过接枝有聚乙二醇(PEG)和pH/GSH双重响应性多聚物聚(SN38-co-4-乙烯基吡啶)的纳米间隙金纳米粒子(AuNNPs)自组装而成的响应性囊泡(AuNNP@PEG/PSN38VP),在NIR-II窗口显示出强烈的PA信号。
2)通过计算模拟,阐明了疏水聚合物PSN38VP的刚性对组装结构的影响以及AuNNP@SN38Ve的形成机理。免疫抑制剂BLZ-945被包裹在囊泡中,导致BLZ-945的pH响应性释放用于靶向免疫治疗,随后囊泡解离成单个AuNNP@PEG/PSN38VP。
3)亲水性AuNNP@PEG/PSN38VP纳米粒在还原性环境下能深入肿瘤组织,并释放抗癌药SN38。同时能在肿瘤深部的NIR-II窗口获得PA信号。
实验结果表明,负载有BLZ-945的囊泡能够增强PA成像引导的同步化疗免疫治疗效果,并抑制原发肿瘤和转移肿瘤的生长。
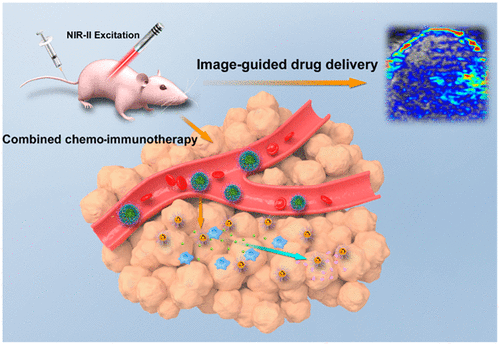
Rong Zhu, et al. Biologically Responsive Plasmonic Assemblies for Second Near-Infrared Window Photoacoustic Imaging-Guided Concurrent Chemo-Immunotherapy. ACS Nano, 2020.
DOI: 10.1021/acsnano.9b07984
https://doi.org/10.1021/acsnano.9b07984
11. Small:NIR-II发光纳米点对急性心肌梗死的瞬时体内成像
临床医师需要在急性梗塞后快速,准确地定位心肌缺血组织,这是朝着准确有效治疗的第一步。如今,早期的心脏病发作诊断是基于生化血液分析(检测心肌酶)或超声辅助成像。研究了替代方法来克服这些经典技术的局限性(耗时的过程或低空间分辨率)。就像在生物医学的许多其他领域一样,心脏病学的临床前成像也可以受益于纳米技术的快速发展。有鉴于此,西班牙IRYCIS的Dirk H. Ortgies、Daniel Jaque等研究人员,将生物功能化的近红外发射纳米颗粒用于急性心肌梗塞后心脏的体内成像。
本文要点
1)利用近红外荧光成像的优异采集速度以及对近红外发射纳米粒子的有效选择性靶向,在急性梗塞事件发生后仅几分钟即可获得梗塞心脏的体内图像。
这项工作为急性心肌梗死后缺血心肌的体内高效成像提供了一种经济高效的途径。
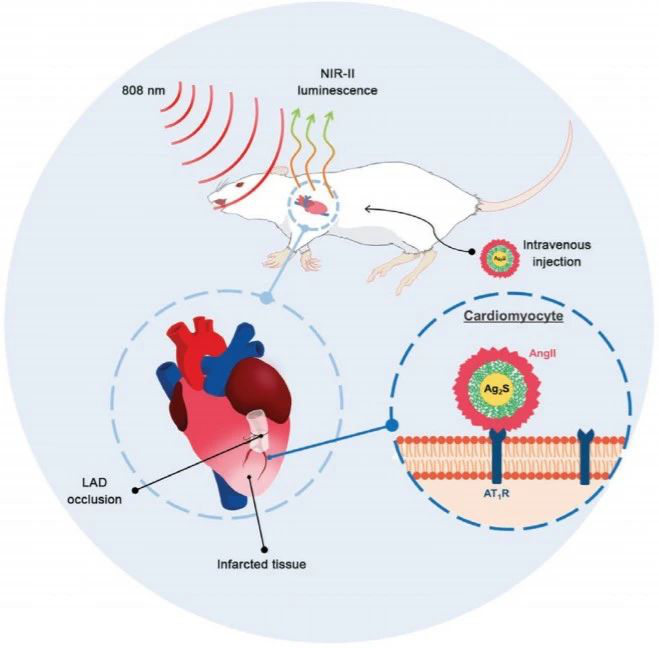
Sergio Mateos, et al. Instantaneous In Vivo Imaging of Acute Myocardial Infarct by NIR‐II Luminescent Nanodots. Small, 2020.
DOI:10.1002/smll.201907171
https://onlinelibrary.wiley.com/doi/full/10.1002/smll.201907171











