
第一作者:刘翀
通讯作者:朱棣文,崔屹
通讯单位:斯坦福大学,芝加哥大学,SLAC国家加速器实验室
研究亮点:
1. 为了提高低浓度Li的选择性,该团队利用了两个有效途径,第一个是利用TiO2涂层增加工作电极和海水之间的界面接触并且提升Li的离子传导;
2. 第二个是利用脉冲电化学方法降低了过电位,以驱动Li插入FePO4晶体结构,从而提高了选择性和结构稳定性。
Li提取技术
储能技术和电子产品的快速发展已将全球锂需求提升到了2015年的约18万吨碳酸锂,预计到2030年将高达160万吨碳酸锂。其中140万吨的需求将用于电动汽车(EV)和插电式混合动力汽车(PHEV)的锂离子电池。到2030年,轻型汽车中有28%可能是电动汽车和插电式混合动力汽车,其中电动汽车约占80%。到2040年,大多数新型出售的轻型车辆将是EV。之所以放弃内燃机汽车,部分原因是全球温室气体排放引起的对气候变化的关注以及对车辆排放PM2.5和NOx的健康问题日益关注。
关于Li资源,陆地上有4360万吨Li,包括蕴藏在矿石中的1670万吨和在盐湖中的2690万吨。目前,从盐湖中提取Li(通常Li浓度在100至1000 ppm之间)主要是基于蒸发和化学沉淀。该方法中用于浓缩Li离子的预处理过程非常耗时。除了陆地资源,海水中存在2000亿吨以上的Li,含量高出陆地5000倍,但Li的浓度仅为0.180 ppm。最近,从石油和天然气开采过程中产生的水中获得的Li也被列为考虑之中。在美国,石油开采期间每年产生25亿加仑的水。假设采出水中Li的浓度为100 ppm,则采出水中每年将回收35万吨锂。
Li资源的供应问题被日益关注,一种高效的Li提取技术可以直接从海水中提取Li,开采过程中无需耗时的蒸发环节,将大大提高锂的生产能力,以满足未来几十年对Li的预期需求。目前的相关研究包括开发吸附材料(例如MnO2或H2TiO3),利用选择性透析。电化学方法是Li提取的一种崭新且有吸引力的途径,它可以利用新能源为电化学过程提供动力。在电化学提取Li的过程中,Li可以被电流驱动进入电极材料或通过Li选择性膜实现分离。对于大多数使用电极材料的研究,目前重点还停留在对高浓度的Li盐水的提取。对于Li浓度低得多的真实海水条件,提高选择性是极具挑战性的。
成果简介
解决全球气候变化和能源危机需要用Li离子电池驱动的电动汽车代替传统燃料汽车。因此,在未来几十年中,对Li元素的需求将急剧增加。海水中的Li含量超过2000亿吨,是陆地矿石和卤水资源总和的5000倍。开发有效的方法以从海水中直接提取Li以确保Li的供应非常有吸引力。然而,海水中Na的浓度比Li高4个数量级,而且Na与Li有相似的化学性质,这对Li的海水提取选择性提出了很大的挑战。
针对Li资源的供应问题,朱棣文,崔屹,刘翀等人开发了一种电化学方法,利用插层化学使用TiO2包覆的FePO4电极实现从海水中提取Li。针对海水里极低的Li/Na比,该研究团队开发了脉冲静置和脉冲静置-反向脉冲静置电化学方法来降低插层过电势,并证明可以成功地提高Li的选择性。此外,脉冲静置-反向脉冲静置方法还可以在Li和Na的共嵌入期间提高电极晶体结构的稳定性,并延长电极的寿命。此方法成功实现了从真实的海水中以1:1的Li: Na摩尔比回收Li,相当于1.8 × 104的选择性。对于有较高的初始Li/Na比(1.6×10-3)的湖水,此方法实现了超过50:1的Li:Na的回收率。相关成果发表在Cell Press旗下的能源旗舰期刊Joule 上,题为“Lithium Extraction from Seawater through Pulsed Electrochemical Intercalation”。
要点1:通过电化学插层提取Li
电化学插层从海水中提取Li的过程如图1所示。第一步,选择能进行Li插层的工作电极。材料的选择必须遵循以下规则:在锂化和脱锂期间,其电位在水稳定窗口之内。海水的pH值为8.2,与标准氢电极(SHE)相比,水稳定窗口设置为 -0.48V到0. 75V。在这项工作中,作者用脱Li的LiFePO4,也就是FePO4,作为工作电极,基于其具有在海水中稳定的锂化和脱锂的平台。在Li提取期间,还存在用于配对对电极的选择标准。由于多种原因需要避免使用产氧作为对电极反应。 a)它会导致海水环境的pH值发生明显变化。b)溶解的氧气会扩散到负极并还原为过氧化物。c)过氧化物会损坏FePO4电极。在本工作中,作者选择NaFePO4作为对电极。在锂的提取过程中,Na将释放到海水中。由于从电极释放的Na的浓度与背景Na相比浓度要低得多,因此可以最大程度地减少对海水的背景环境影响。在Li提取步骤中,将两个电极放入海水中,并将系统保持在氮气气氛中(图1b)。在第二步中,将充满的FePO4电极放入新的回收溶液中,通过反向电压将Li释放到溶液中并同时排空FePO4电极。
从海水中提取Li的挑战在于共存的Na离子。Li的化学性质与Na相似,但浓度低得多。 FePO4的Li嵌入电位相对于SHE为0.36 V,而Na的嵌入电位相对于SHE为0.19V。Li插层的电位差可以补偿Li/Na的摩尔浓度比至0.0012。在盐水或盐湖水中,Li与Na的浓度比约为0.0018至0.3,根据图1c所示的计算,插层化学应具有极高的Li选择性。就海水而言, Li/Na的浓度比低至5×10-5,Na将与Li竞争嵌入到电极中。考虑到Li和Na之间的竞争,作者采取了不同的策略来促进Li的嵌入。
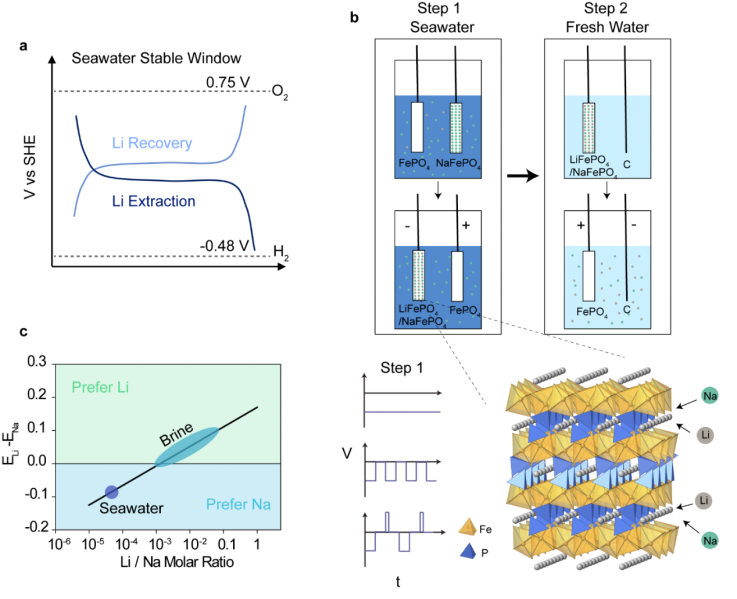
图1. 通过电化学插层从海水中提取Li。a,示意图描述插层电极选择需要在海水稳定窗口内。b,Li提取步骤的示意图。首先,使用FePO4电极和NaFePO4作为海水中的工作电极和对电极进行Li嵌入。然后,工作电极在回收溶液中再生并释放提取的Li。c,使用FePO4电极计算初始Li与Na摩尔浓度不同时的Li和Na嵌入电位差。
要点2:脉冲电化学方法提高Li的选择性
首先,为了增加电极与海水接触,在电极制造后,作者在FePO4的表面引入了亲水涂层。在这里,作者选用了通过原子层沉积法的TiO2作为涂层。Li在非晶态TiO2中的扩散率与FePO4处于同一数量级,因此薄涂层不会增加Li扩散的势垒。此外,与Na相比,TiO2的Li扩散势垒更小,这有助于改善Li对Na的选择性。作者研究了两种厚度的TiO2涂层,分别为3 nm和5 nm。TiO2涂层的厚度没有显着改变电极的电导率。在海水提锂中,从电化学曲线(如图2A所示)可以明显看出,3 nm和5 nm的TiO2涂层都降低了Li插入的过电势。然后,作者在淡水溶液中通过脱锂过程测试了从电极回收的Li和Na。如图2B所示,对于具有0 nm,3 nm和5 nm的TiO2涂层的FePO4电极,Li /(Li + Na)的摩尔比为30.2±2.1%,48.0±1.9%和44.9±7.4%。由于3 nm TiO2涂层具有最高的选择性,因此作者在后续所有电化学方法选择测试中都采用了这一条件。
接下来,作者对电化学方法进行优化以提高Li的选择性。不同的电化学嵌入方法将导致不同的过电势来驱动Li提取过程。作者将恒流插层方法与脉冲静止和脉冲静止-反向脉冲静止方法进行了比较。对于脉冲静止方法,测试了具有10 s静止10 s插层(P10s)和1 s静止1 s插层(P1s)的方法。电化学曲线示于图2C。对于相同容量的锂提取,脉冲停止方法P10s和P1s均显示出比恒流方法小0.05V的过电势。电极阻抗在所有测试中均相似。结果,在脉冲电化学方法P10s和P1s中,回收的Li /(Li + Na)摩尔比分别比恒定电流方法中的31.4±1.7%更高,分别为49.7±0.35%和47.4±5.1%(图2D)。)。脉冲锂化方法为电极提供了一个休息时间,使锂和钠重新分布在电极中的所有颗粒中,并确保所有颗粒中的锂/钠含量更加均匀,从而改善了电极的均一性并减少了插层的过电势。除了脉冲静止方法外,还测试了脉冲静止-反向脉冲静止方法。在这种方法中,在一个周期中既有正向脉冲又有反向脉冲。正向脉冲及其静止周期均为10 s,振幅相同的反向脉冲及其静止周期分别为2 s和10 s(P10sR2s)。在电化学过程中经常使用反向脉冲来产生更均匀的浓度前沿。如图2D所示,该脉冲静止-反向脉冲静止方法的选择性为50.2±0.78%。它也比恒流方法高。脉冲电化学方法的引入成功地促进了Li的嵌入。在这三种脉冲方法中,第一循环的选择性类似于1:1的Li / Na回收比,这相当于Li对Na的海水选择性为1.8×104。
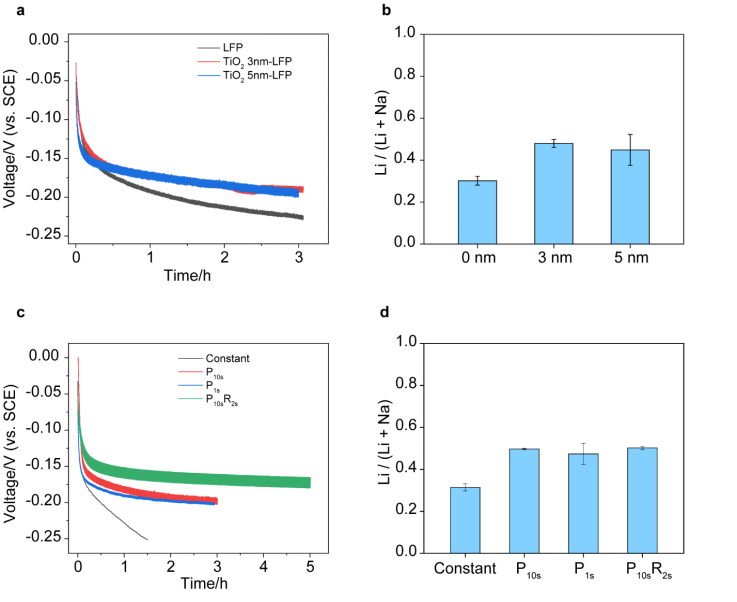
图2. a,0 nm,3 nm和5 nm TiO2涂层的FePO4电极在海水中的插层电化学曲线。b,具有不同厚度的TiO2涂层的FePO4电极的Li选择性。c,TiO2-FePO4电极通过不同的电化学方法在海水中的插层电话学曲线:恒定电流,P10s,P1s和P10sR2s。d,TiO2-FePO4电极采用不同的电化学方法的 Li选择性。
要点3:循环稳定性测试
作者研究了三种脉冲电化学方法(P10s,P1s和P10sR2s)的循环稳定性。每个循环都涉及Li的提取和回收过程并测量Li的选择性和法拉第效率。在循环测试中,这三种方法在稳定性方面存在明显差异,如图3所示。在脉冲方法P10s和P1s中,选择性和库仑效率都显示出下降的迹象。P1s下降速度更快,在第5个循环后,选择性从Li /(Li + Na)摩尔比50%降至31.9±0.40%。在第7个循环中,Li /(Li + Na)的摩尔比仅为13.5±0.68%。在P10s中,选择性在第6个周期开始下降,而在第10个周期之前,选择性在30-36%之间。在第10个循环中,选择性下降至10.8±0.97%。但是,对于P10sR2s方法,在10个循环内没有电极不稳定的迹象,并且循环的选择性维持在50%。P10s和P1s方法中电极循环稳定性的下降可能是由于Li和Na的共嵌入行为引起的。在共嵌入过程中,Li和Na的扩散率不同,这可能导致扩散较慢的Na引起局部堵塞。相反,反向脉冲和静止周期将允许Li和Na重新分布并减小电极的局部应力。同样,作者假设反向脉冲可以帮助从电极中除去Na,因为Na脱嵌的电位比Li脱嵌的电位低。这有利于增强电极的长期稳定性。另外,作者通过将电极直接在海水中浸泡24小时,对TiO2-LiFePO4进行了稳定性测试,并通过溶解测量了电极中Li和Fe的含量。根据Li和Fe的浓度,计算出LiFePO4的质量负载,与原始质量负载相比没有明显变化,误差分别为-2%和+4%。
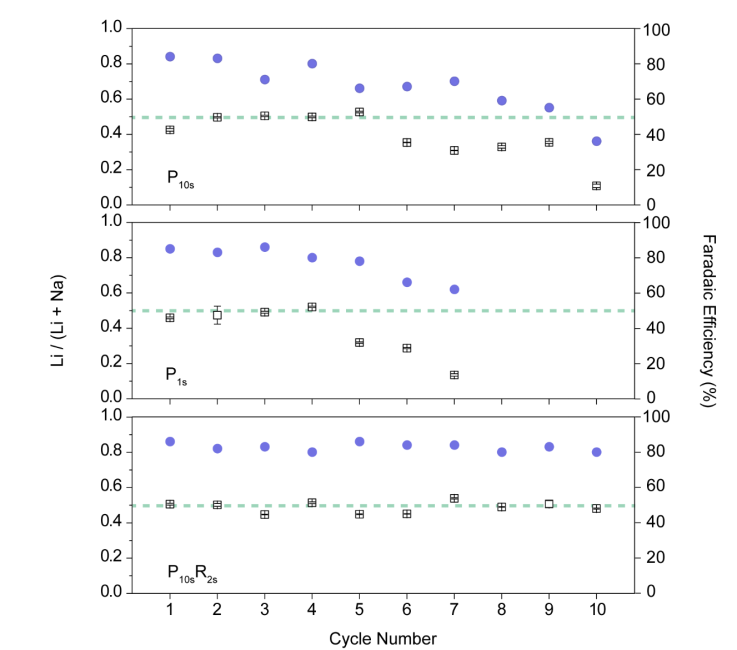
图3. 在不同电化学方法进行循环稳定性测试的Li选择性和法拉第效率结果。
要点4:电极循环后表征
作者使用扫描电子显微镜(SEM)和透射电子显微镜(TEM,图4)对P10sR2s方法中的FePO4颗粒进行表征。在电极选择性测试第10个循环后进行了另一次插入。从SEM图像来看,电极的形貌只有微小的变化。SEM成像后,将FePO4颗粒从电极上超声处理以进行TEM表征。图4中显示了三个颗粒代表电极上的粒子。Li元素用电子能量损失谱(EELS)表征。 Na和Fe元素通过能量色散X射线谱(EDX)进行表征。Fe用作LiFePO4的参考。Li EELS信号表明,插层遵循相变,类似于在电池阴极中的Li插层,其边缘具有较高的Li浓度。在边缘浓度较高的情况下,Na表征未提供相同的分布。但是,从该图可知,Na均匀地存在于粒子表面,这表明Li和Na共存于结构中。同时X射线衍射(XRD)也确认了共插入。从形态方面来看,颗粒在循环后保持其完整性,但是在颗粒上发现了细小裂纹,这可能是由于插层后电极的膨胀引起的。
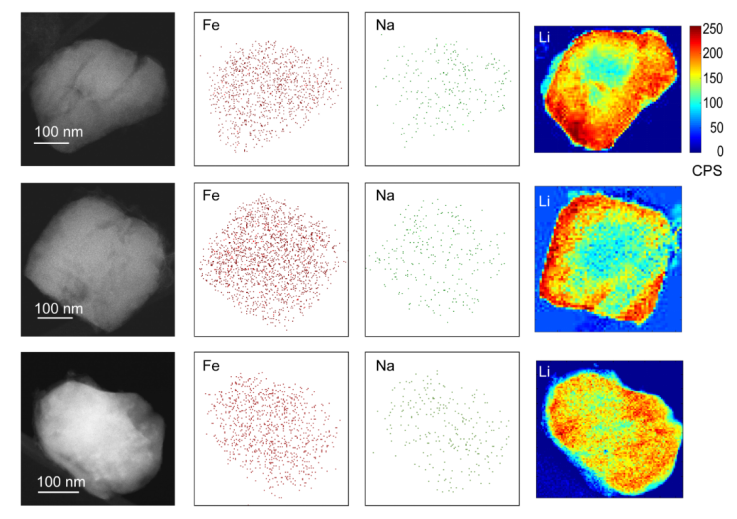
图4. 使用P10sR2s电化学方法提取和回收Li的10个循环后,FePO4颗粒的TEM表征。从左到右:FePO4颗粒的TEM图像,Fe EDX元素分布,Na EDX元素分布,和Li EELS元素分布。
要点5:电化学提Li的高选择性和高收率
最后,作者证明了电化学插层可以从不同的Li:Na摩尔比的人造盐水以及从犹他州盐湖获得的盐湖水提取Li。测试了Li与Na之比为5.4×10-5, 5.0×10-4和4.0×10-3的模拟溶液。Li与Na之比为5.4×10-5类似于海水情况。如图5所示,使用相同的P10s电化学方法,选择性分别为50.2±0.78%,94.3±4.0%和接近100%(Na低于检测限)。这表明如图1c所示,在插入FePO4材料中,Li对Na的热力学选择性优势。作者还从犹他州盐湖收集了湖水。通过ICP-MS测量,湖水中含有21.4 ppm的Li和4.26×104 ppm的Na。Li和Na的浓度均高于海水中的浓度,Li/Na比为1.6×10-3。在电流为C/5的相同P10s电化学方法中,回收的Li/(Li + Na)摩尔比为98.1±1.0%。还测试了P10s电化学方法更高的1C电流速率。回收的Li/Li + Na)摩尔比为90.6±4.7%。更高的电流代表更高的生产率,并且结果显示出电化学提Li具有高选择性和高收率的巨大潜力。在实际应用中,作者提出希望在当前的回收步骤之后增加一个类似于盐水开采的额外步骤,以将Li沉淀到Li2CO3中以进一步使用。
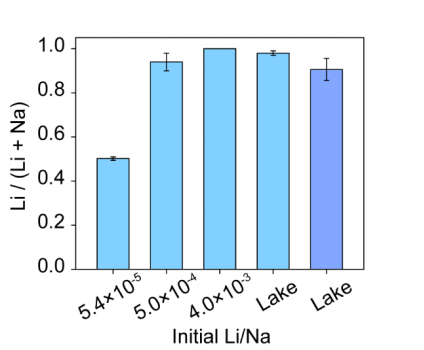
图5. 使用P10s电化学方法和TiO2-FePO4电极在具有不同的初始Li/Na摩尔比和真实湖水的溶液中的Li选择性结果。对于湖水,测试了两种不同的流速。C/5速率结果显示为浅蓝色(左),而1C速率结果显示为深蓝色(右)。
小结
作者证明了用电化学插层法和FePO4电极能够成功从海水和盐湖水中提取Li。通过引入亲水涂层以及脉冲电化学方法可以降低嵌入过电势从而提高Li的选择性。通过使用脉冲-静止-反向脉冲-静止的方法,作者实现了从海水中稳定提取Li的10个循环,Li / Na的回收率为1:1,这相当于1.8 × 104的选择性。虽然电化学海水提Li显示了巨大的潜力,这种方法需要稳定的进行成百上千的电化学循环。因此,即使在重复循环后有少量的Na插入电极材料中,也会导致应力裂纹和电化学容量的损失。以后的工作应寻求开发改进的亲水性界面涂层,该涂层将作为防止Na侵入电极的屏障。此外,为防止电极在长期使用中结垢堵塞,必须对海水(或盐湖水或采油后产生的水)中的微米,纳米和粒子/分子进行过滤。作者认为这些障碍是可以克服的,这项工作对确保Li的充足供应以及提高电动汽车的大规模部署提供了可行的解决方案。
参考文献:
Chong Liu et al. Lithium Extraction fromSeawater through Pulsed Electrochemical Intercalation. Joule, 2020.
DOI: 10.1016/j.joule.2020.05.017
https://www.cell.com/joule/fulltext/S2542-4351(20)30235-X
作者介绍:

第一作者:刘翀,芝加哥大学Pritzker分子工程学院Neubauer Family助理教授。2015年于美国斯坦福大学材料系获得博士学位。2015-2018年于朱棣文和崔屹教授课题组从事博士后工作。主要研究方向有分离技术,水净化空气净化技术,材料的设计和合成,电池及催化等。在Nature Nanotechnology,Nature Energy, Nature Communication, Nano Letters等杂志发表30多篇论文。

通讯作者:朱棣文,斯坦福大学物理系以及分子和细胞生理学系William R. Kenan Jr.教授。1997年诺贝尔物理奖得主。美国国家科学院,美国艺术与科学研究院,美国哲学学会和台湾中央研究院的院士,以及中国科学院和韩国科学院的外籍院士。美国AAAS协会主席。在Science,Nature等杂志上发表超过300篇文章。

通讯作者:崔屹,1998年在中国科学技术大学获得理学学士学位,2002年在哈佛大学获得博士学位,2003-2005年在加州大学伯克利分校从事博士后研究,现为美国斯坦福大学材料系终身教授,英国皇家化学学会会士,美国材料学会会士,电化学学会会士。现任Nano Letters副主编、美国湾区太阳能光伏联盟(Bay Area Photovoltaics Consortium)主任以及美国电池500联盟(Battery500 Consortium)主任。崔屹教授课题组研究方向包括高能硅负极、高能锂离子电池、锂金属电池、电催化二氧化碳还原、电催化水分解、氧还原、智能调节人体温度的高分子纤维织物、高效过滤PM 2.5颗粒、冷冻电镜等研究领域。在Science, Nature等杂志发表超过300篇论文。H因子为166(Google Scholar),授权国际专利40余件。获得奖项包括2019年度Dan Maydan奖, 2019 Nano Today奖,2017年度Blavatnik青年科学家奖, 2015年MRS Kavli Distinguished Lectureship in Nanoscience, Resonate Award for Sustainability,2014年Nano Energy奖,2013年IUPCA(国际理论化学与应用化学联合会)新材料及合成杰出奖,2011年哈佛大学威尔逊奖,2010年斯隆研究基金,2008年KAUST研究奖,2008年ONR 年轻发明家奖,2007年MDV创新奖等,2004年入选“世界顶尖100名青年发明家”。











